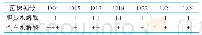
《表1 S.cerevisiae PDE1蛋白原液酶活性》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《酿酒酵母环核苷酸磷酸二酯酶1的异源表达、分离纯化与活性检测》
注:a.被标记的3H在闪烁计数器下的闪烁次数;对照为不加PDE1蛋白的assay buffer。
对纯化后的PDE1蛋白进行酶活性测定,如表1所示,PDE1蛋白活性较高,对cAMP的水解率到90%以上。进一步证明经3次纯化后重组目的蛋白能够保持其原有的生物学特性。为验证S.cerevisiae PDE1蛋白是一种能够同时水解cAMP和cGMP的酶,通过不同质量浓度的蛋白水解两种底物的产物转化率进行线性分析,结果如图7所示。随着蛋白质量浓度的升高,底物转化率也升高,且具有一定的线性关系。结果证明,在MnCl2催化下,150 ng/mL S.cerevisiae PDE1蛋白对3H-cAMP的底物转化率能达到50%左右,而在300 ng/mL S.cerevisiae PDE1蛋白质量浓度条件下,对3H-cGMP的底物转化率能达到50.5%。此结果印证了关于S.cerevisiae PDE1蛋白是一种双底物酶的结论,同时,也证明本实验纯化蛋白具有很高的生物活性。
| 图表编号 | XD00225594500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.25 |
| 作者 | 陈滢、李赤霞、陈玉娟、田元元、张萌、韩潆仪、王友升 |
| 绘制单位 | 北京食品营养与人类健康高精尖创新中心北京工商大学轻工科学技术学院、北京食品营养与人类健康高精尖创新中心北京工商大学轻工科学技术学院、北京食品营养与人类健康高精尖创新中心北京工商大学轻工科学技术学院、北京食品营养与人类健康高精尖创新中心北京工商大学轻工科学技术学院、北京食品营养与人类健康高精尖创新中心北京工商大学轻工科学技术学院、北京食品营养与人类健康高精尖创新中心北京工商大学轻工科学技术学院、北京食品营养与人类健康高精尖创新中心北京工商大学轻工科学技术学院 |
| 更多格式 | 高清、无水印(增值服务) |