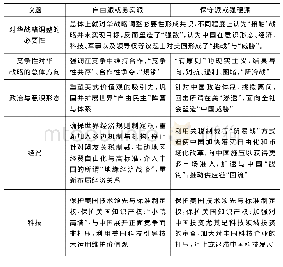
《表1 美国关于儿童药品的政策法规历史沿革》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《美国儿童药品上市审批情况分析及其对我国儿童用药保障工作的启示》
针对儿童药品品种不足的情况,美国率先采取立法的形式从根本上着力改善儿童药品的可及性和安全性问题。早在20世纪90年代,美国便陆续出台了一系列政策法规,如《小儿说明书规则》(The Pediatric Labeling Rule)、《FDA现代化法案》(FDA Modernization Act,FDAMA)、《小儿法则》(The Pediatric Rule)等。其中,FDAMA中明确提出了多项鼓励发展儿童药品的举措,更是首次提出了国家为制药企业开发儿童药品提供经济鼓励。为了促使更多的企业进行儿科研究,获取更多儿童用药的相关数据,美国又于2002年和2003年相继制定了《最佳儿童药品法》(Best Pharmaceuticals for Children Act,BPCA)和《儿科研究公平法》(Pediatric Research Equity Act,PREA)[5],且《FDA安全与创新法》(Food and Drug Administration Safety and Innovation Act,FDASIA)授权上述两法案长期有效[6]。此外,FDASIA还规定,研究者应当在新药研制的早期阶段就递交药品的初期研究计划,目的是在研制新药期间,尽早考虑未来能否适用于儿童,并根据计划开展同步的儿科研究。美国关于儿童药品的政策法规历史沿革[4]见表1。
| 图表编号 | XD00216767300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.30 |
| 作者 | 王雅君、韩容、岳志华、许馨文、赵志刚 |
| 绘制单位 | 首都医科大学附属北京天坛医院药学部、首都医科大学药学院、首都医科大学附属北京天坛医院药学部、国家药典委员会化药处、中国医药新闻信息协会儿童安全用药分会秘书处、首都医科大学附属北京天坛医院药学部 |
| 更多格式 | 高清、无水印(增值服务) |