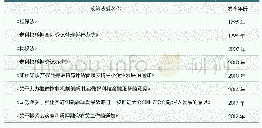
《表3 我国儿童药品保障工作相关的政策与法规》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《美国儿童药品上市审批情况分析及其对我国儿童用药保障工作的启示》
2003年,我国颁布《药物临床试验质量管理规范》首次将儿童纳入临床试验对象,为儿科试验的进行奠定了基础。随后在2011-2013年,我国相继出台了多项鼓励儿童药品研发的相关政策,旨在加快具有临床试验数据支持的儿童药品的注册申请审评。2014年,国家卫生计生委等六部委共同印发了《关于保障儿童用药的若干意见》,为保障儿童基本用药需求、促进儿童用药安全科学合理使用以及儿童药品的发展指明了方向。后续几年,国家频频出台多项政策,先后成立了儿童用药专家委员会,以指导儿童药品的审批及使用;要求医疗机构配备儿童药品,增加儿童用药的可及性;对儿童药品实施优先审评审批等,陆续制定了3批鼓励研发申报儿童药品清单,以鼓励我国儿童药品的研发与试验,促进我国儿童药品行业的快速健康发展。2020年最新版的《药物临床试验质量管理规范》中又特别强调了对儿科临床试验中儿童受试者的保护。一系列政策的出台,充分彰显了我国政府部门鼓励研发申报儿童药品的决心和力度,也使我国儿童药品的行业发展目标更加具体。近年来出台的我国儿童药品保障工作相关的政策与法规见表3。
| 图表编号 | XD00216767700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.30 |
| 作者 | 王雅君、韩容、岳志华、许馨文、赵志刚 |
| 绘制单位 | 首都医科大学附属北京天坛医院药学部、首都医科大学药学院、首都医科大学附属北京天坛医院药学部、国家药典委员会化药处、中国医药新闻信息协会儿童安全用药分会秘书处、首都医科大学附属北京天坛医院药学部 |
| 更多格式 | 高清、无水印(增值服务) |