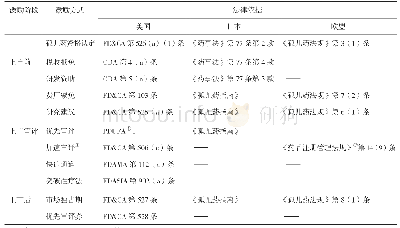
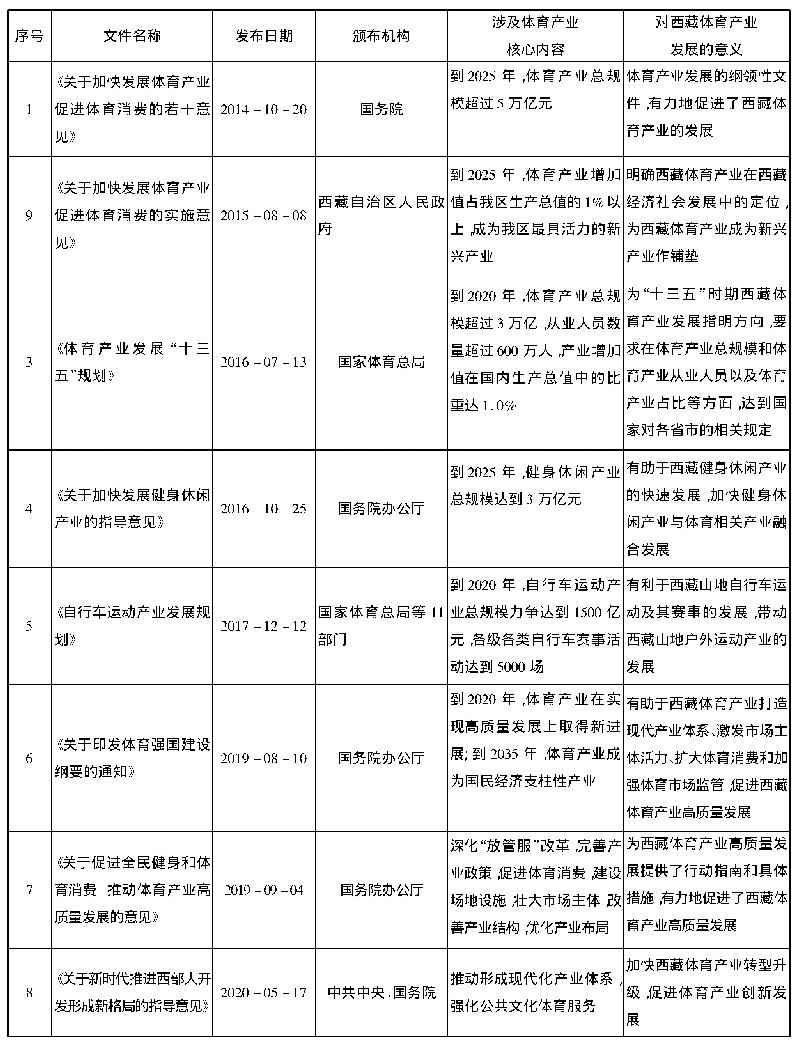
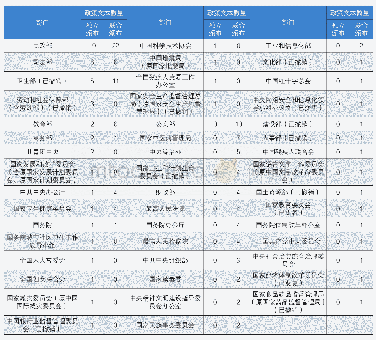
《表1 我国有关保障孤儿药市场的政策法规颁布时间及相关内容》
迄今我国尚没有专门的孤儿药法律,现存孤儿药市场保障法规零散地分布在相关的政策之中(表1),尚未形成体系。一般而言,研发一种孤儿药新药,需要10年左右的时间、上亿美元甚至更多资金的投入,成功率却很低仅10%[6];加之罕见病病种太多,单个病种患者人数稀少,市场狭窄,若没有相应的制度保障研发风险很大。我国新药研发能力相当薄弱,加之药物研发成本极高,又缺乏政策激励(如研发经费支持等)及法律保障(如一定期限的市场独占权),企业缺乏研发动力。故就目前而言,我国孤儿药自主研制市场几近空白,主要依赖进口。然而,我国现行的《药品进口管理办法》(局令第4号)存在着诸多问题,如药品临床试验样本量要求过高、检验样品量过大、注册审批周期过长及进口税过重等问题[7]。药物在国内审批上市,一般需要3~8年,以11种治疗白血病药品的上市为例,平均比美国上市时间晚6.6年[8];三期临床试验需要3 000例病例证实,而有的疾病极为罕见如戈谢氏病全国仅发现100多例根本无法满足相关要求,这些因素严重阻碍了罕见病药品在我国的引进与上市。迄今为止,已在我国上市的孤儿药仅154种,远远不能满足7 000种罕见病患者的治疗需求。
| 图表编号 | XD00173595500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.05 |
| 作者 | 刘芸男、彭荣荣、杨小丽 |
| 绘制单位 | 重庆医科大学公共卫生与管理学院医学与社会发展研究中心健康领域社会风险预测治理协同创新中心、重庆医科大学公共卫生与管理学院医学与社会发展研究中心健康领域社会风险预测治理协同创新中心、重庆医科大学公共卫生与管理学院医学与社会发展研究中心健康领域社会风险预测治理协同创新中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式