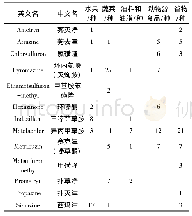
《表1 美国食品药品监督管理局(US FDA)对计划书中试验开始和试验结束日期的历史规定》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《良好实验室规范下生态毒理测试SOP的日程设计与合规化管理》
注:FDA表示食品药品监督管理局(美国),GLP表示良好实验室规范。
但是,US FDA在1984年发布的GLP法规修订版[4]中,提议删掉上述§58.120(a)(4)条款,理由是根据§58.120(b)条款(已批准的计划书发生的任何修改或者修订,必须说明理由,经SD批准签字和签署日期后与原计划书一同保管),计划书批准后试验日期发生改动时,项目负责人必须对研究计划进行修订。但是从另外一个角度来说,US FDA认为测试机构在试验日程设计和安排方面具有自主决定权。所以为了避免因日程变化而修订计划书的情况,US FDA提议删掉§58.120(a)(4)条款。随后,在1987年发布的FDA GLP法规最终修订版[5]中,原§58.120(a)(4)规定被删除(表1)。自此,US FDA不再要求计划书中必须包含预计的试验开始和试验结束日期。自该版本后,后续所有US FDA发行的GLP法规都不再对计划书的预计试验起始时间有强制规定。
| 图表编号 | XD00154857700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.01 |
| 作者 | 汪丹、姚洪伟、周芳丽 |
| 绘制单位 | 上海化工院检测有限公司、上海化工研究院有限公司、上海化工研究院有限公司 |
| 更多格式 | 高清、无水印(增值服务) |