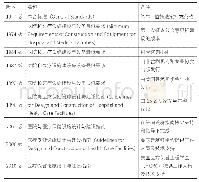
《表1 中国1998版药品GMP、2010版药品GMP和美国FDA版cGMP的对比》
Good Manufacturing Practice(GMP)是国际通用的生物制药生产质量管理规范。实行《2010版药品GMP》使我国向国际化质量管理进一步靠拢。从1998版药品GMP的87条规定扩展至2010年的313条正式规定,我国的药品生产法规逐步完善。企业需更为重视生产人员的培训和任用,并对质量管理部门的职责有了进一步明确。例如批间一致性和生产记录原始性问题,2010版比《药品生产质量管理规范(1998年版)》(简称《1998版药品GMP》)有了更为清晰完整的说明,因此疫苗事件爆发后,监管部门能够及时反应判定其违反药品生产质量规范。相比于美国食品药品监督管理局 (FDA)的cGMP规定,我国的质量管理规范在人员职责、质量管理、生产记录方面还有更多的提升空间。具体对比如表1所示。
| 图表编号 | XD0095454600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.07.09 |
| 作者 | 殷丹静、张新宇 |
| 绘制单位 | 南京中医药大学药学院、美国北卡罗来纳州立大学生物制造培训教育中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式