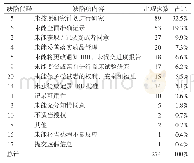
《表1 美国食品和药物管理局临床试验研究者检查清单(CIIL)缺陷代码表与联邦法规第21篇(21CFR)对照表》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《美国食品和药物管理局发布的临床试验研究者警告信分析》
IND:研发中的新药,IRB:伦理委员会,n/a:不适用,*:2005年之后加上的条款
统计FDA对临床试验研究者发出警告信的数量以及提出问题的数量和分布情况。将警告信提出的问题分别对应联邦法规第21篇(Code of Federal Regulations Title 21,21CFR)食品和药品条款[8]、FDA临床试验研究者检查清单(Clinical Investigator Inspection List,CIIL)缺陷代码(见表1)[9]和人用药品注册技术要求国际协调会议(International Conference on Harmonization,ICH)药物临床试验质量管理规范(Good Clinical Practice,GCP)中研究者内容条款[10]进行分类,分析各类问题的具体表现。
| 图表编号 | XD00199078600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.25 |
| 作者 | 孙搏 |
| 绘制单位 | 上海药品审评核查中心 |
| 更多格式 | 高清、无水印(增值服务) |

![表1 目前已获美国食品和药物管理局批准上市的TPO受体激动剂[1,5-8]](http://bookimg.mtoou.info/tubiao/gif/XYYL202011004_00800.gif)