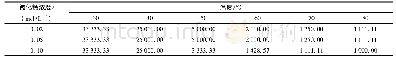
《表3 不同IPTG处理条件下bace16敲低菌株的蛋白酶及杀线虫活性》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《利用CRISPR/dCas9系统构建适用于芽胞杆菌基因敲减的重组质粒及其应用》
同列数字后标记的不同小写字母表示差异显著(P<0.05)
为了探究p BD1系统在芽胞杆菌中的基因敲低功能,采用杀线虫芽胞杆菌B16菌株的bace16作为靶标基因。d Cas9用于大肠杆菌基因表达调控的研究显示,只有靶向基因非模板链的sg RNA才能有效抑制基因表达,而且sg RNA靶向位置越靠近转录起始位点则抑制效率越高(Qi et al.,2013)。本研究将3条靶向不同位置的sg RNA1~3装入重组质粒p BD1,分别电转入杀线虫芽胞杆菌B16,产生3种表达不同sg RNA的基因敲低突变株。实时荧光定量PCR结果显示,表达sg RNA2和sg RNA3的菌株中,bace16基因的表达量与野生株相比没有明显变化;而表达靶向非模板链启动子区sg RNA1的敲低突变株中,bace16基因表达量相比对照菌株明显下降(图4)。脱脂牛奶平板上的结果显示(图5),sg RNA1表达菌株的bace16蛋白酶活性也发生显著变化,在没有IPTG诱导的情况下,表达sg RNA1的敲低菌株和对照菌株(转化p BD1空质粒)的透明圈直径(约为6.0 cm)没有显著差别;在IPTG诱导下,bace16蛋白酶水平所下降,当IPTG浓度为1.0mmol/L时,透明圈几乎丧失,与对照比较差异显著(表3)。上述结果提示,表达sg RNA1能有效抑制bace16表达,且该抑制能实现可逆回复。
| 图表编号 | XD00204543200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.25 |
| 作者 | 陶冶、赵素雅、尹晓燕、刘苏瑶、魏旭阳、牛秋红 |
| 绘制单位 | 南阳师范学院生命科学与技术学院、南阳师范学院生命科学与技术学院、南阳师范学院生命科学与技术学院、南阳师范学院生命科学与技术学院、南阳师范学院生命科学与技术学院、南阳师范学院生命科学与技术学院 |
| 更多格式 | 高清、无水印(增值服务) |