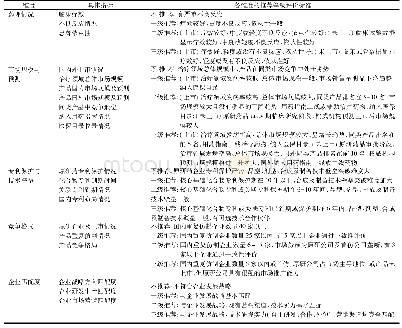
《表1 美国仿制药一致性评价相关政策法规》
1984年《Hatch-Waxman法案》允许通过生物等效性数据申报仿制药,并鼓励其与原研药竞争[1]。但仿制药欺诈丑闻紧随而来,为了重新建立公众对仿制药的信心,随后出台了多项政策来确定市场上的仿制药是否满足质量标准,进行了大量再评价工作[2],相关政策进展见表1。FDA下设了仿制药品办公室(OGD)专门负责仿制药审评工作,法规允许仿制药企业通过生物等效性(BE)研究替代原研药的临床试验数据来证明两者一致性,BE研究相比其复杂的重复临床研究节省了很多人力物力,为企业和社会节省了大量资源。但BE研究投入的资源还是较多,一定程度上会限制仿制药发展,随后法规还提出了生物等效性豁免,对一些性质明确且生物等效性影响也很清楚的药物进行豁免。
| 图表编号 | XD00199147900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.28 |
| 作者 | 胡宇、宗欣、于淼、李勇 |
| 绘制单位 | 中国药科大学国际医药商学院、国家药品监督管理局信息中心、国家药品监督管理局信息中心、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式