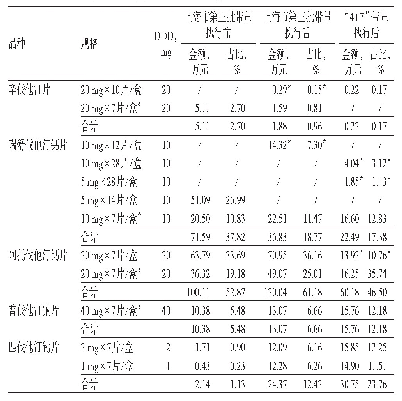
《表3 他汀类药物国内现有仿制药厂商2018年底一致性评价申报与通过情况》
数据来源:米内网
根据《意见》,《国家基本药物目录(2012年版)》中的289种仿制药(俗称289目录),应在2018年底前完成一致性评价;对于化学药品新注册分类实施前批准上市的其他仿制药,非首仿药应于首仿药通过一致性评价后3年完成一致性评价;逾期未完成的,不予再注册。表3汇总了降血脂的三款代表药品中,国内现有仿制药厂商在2018年底前———即“4+7”带量采购前后的一致性评价参与情况:其中主流产品阿托伐他汀和瑞舒伐他汀厂商较为积极,瑞舒伐他汀更是所有厂家都参与一致性评价。值得注意的是,带量采购的药品目录在2018年9月才出炉,这说明厂家认为一致性评价能提高药品的竞争力。然而,属于289目录、申报即将截止的辛伐他汀市场反应并不积极,83家国内现有仿制药厂家只有2家参与一致性评价。老一代一致性评价参与程度低,并非降血脂药品市场独有。实际到2018年底,289目录中只有26个品种有厂商完成一致性评价。其中原因可能是相较于过百万的一致性评价成本,厂家认为老一代的市场利润空间不够。一致性评价的厂家参与程度并非仅仅取决于政策指令,商业因素也考虑在其中。
| 图表编号 | XD00162278400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.12.25 |
| 作者 | 陈志洪、张洲驰 |
| 绘制单位 | 上海交通大学安泰经济与管理学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式