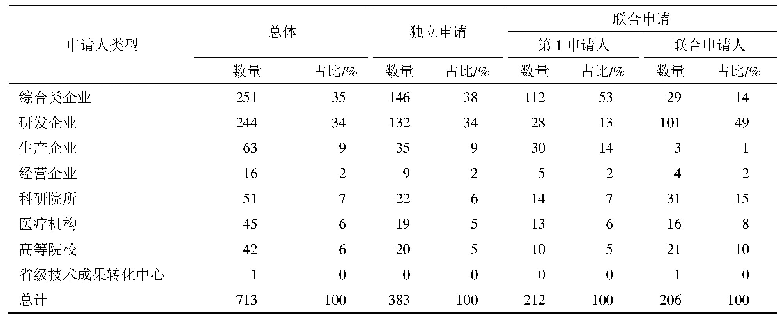
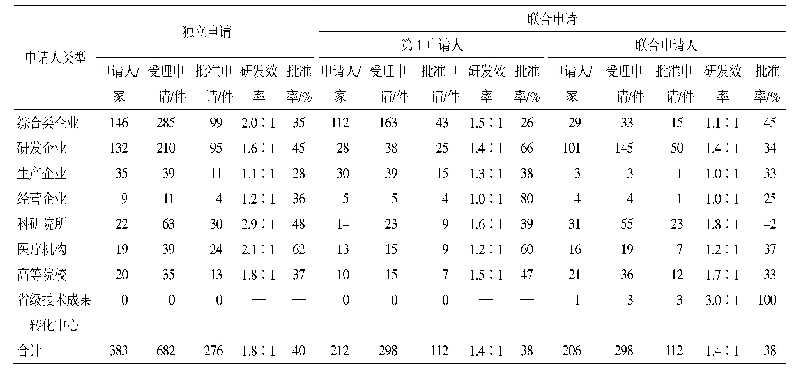
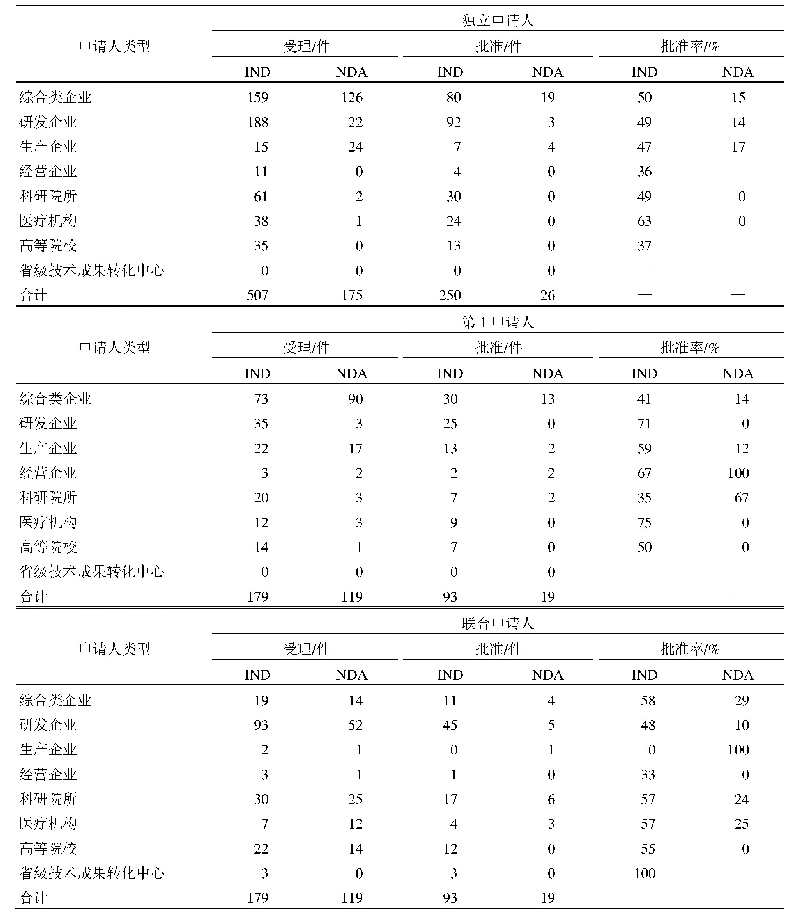
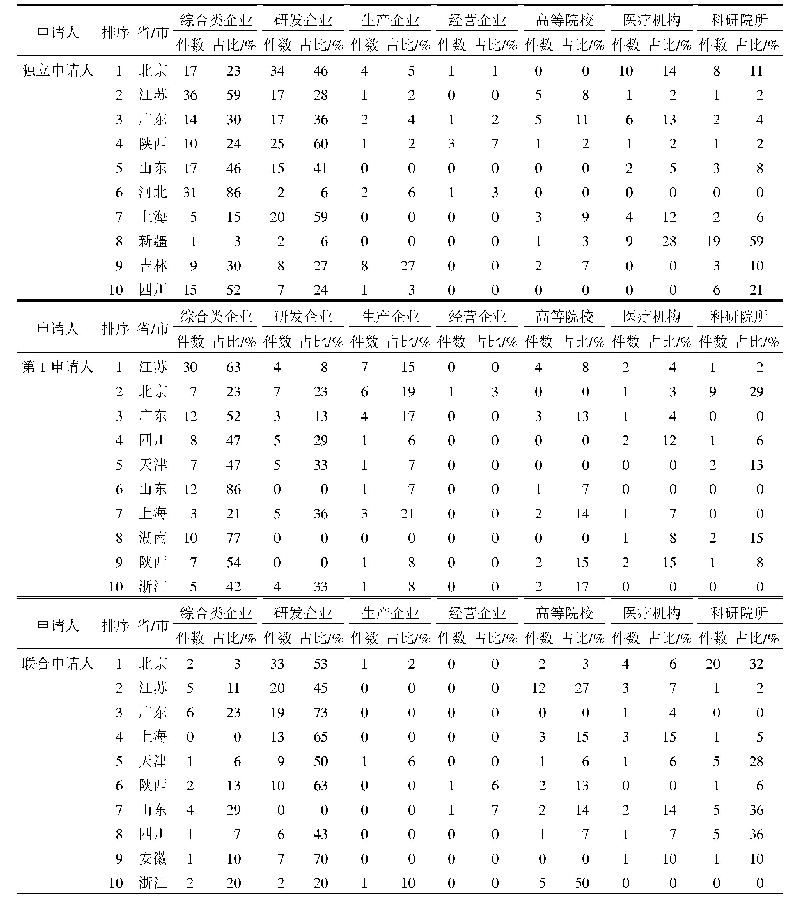
《表2 紧急研究用新药申请递交时间表》
当满足以下所有条件时,医生可能决定通过个例患者紧急研究用新药(EIND)申请(见表2)来请求使用某款研究用产品:(1)患者患有严重的疾病或状况,或者其疾病或状况立即威胁生命;(2)没有替代疗法或产品来诊断、监测或治疗该疾病或状况;(3)无法将患者纳入临床试验;(4)潜在的患者利益大于治疗的潜在风险;(5)提供研究用医疗产品不会干扰可以用于支持医疗产品开发或销售该治疗适应证的研究试验。
| 图表编号 | XD00177547400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.03.25 |
| 作者 | 陈谨、徐然、赵东、杜涛 |
| 绘制单位 | 汉佛莱医药顾问有限公司、汉佛莱医药顾问有限公司、汉佛莱医药顾问有限公司、汉佛莱医药顾问有限公司 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式