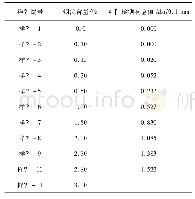
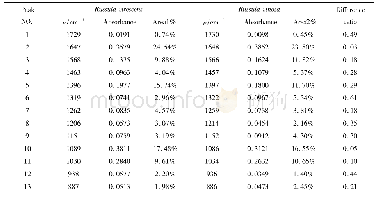
《表1 LF与LF-Cur复合物傅里叶变换红外光谱的峰值》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《天然和热变性乳铁蛋白与姜黄素复合物的结构表征及结合机理研究》
注:LF-Cur复合物中Cur含量为1.08×10-4mol/L。
天然LF在1653 cm-1处和热变性LF在1654 cm-1处的吸收峰为酰胺Ⅰ带的C=O伸缩振动[39-40];如表1,LF25℃在1535 cm-1处和LF90℃在1541 cm-1处的吸收峰为酰胺Ⅱ带的N-H弯曲振动和C-N伸缩振动[41-43]。C=O键和C-N键的伸缩振动均与蛋白质二级结构单元间的氢键有关[44]。添加Cur(1.08×10-4mol/L)前后,LF在酰胺I带(1600~1700 cm-1处)没有明显差异,但在酰胺II带(1535 cm-1处)有明显红移(约4 cm-1)。LF25℃的酰胺II带从1535和1450 cm-1分别红移至1530和1444 cm-1;而LF90℃的酰胺II的峰从1455 cm-1蓝移至1456 cm-1。上述结果表明Cur与蛋白质亚基结构中的C=O和C-N基团发生了相互作用。
| 图表编号 | XD0093962800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.15 |
| 作者 | 邓楚君、许琳霜、李波、杨伟 |
| 绘制单位 | 河南科技学院食品学院、河南科技学院食品学院、河南科技学院食品学院、河南科技学院食品学院 |
| 更多格式 | 高清、无水印(增值服务) |