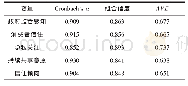
《表4 EMA对ATMPs的监管》
欧洲药品管理局(European Medicines Agency,EMA)将基于基因、组织或细胞的人类用药定义为前沿药物(advanced therapy medicinal products,AT-MPs),它包括3种主要类型:(1)基因治疗药物:包含具有治疗、预防或诊断效应的基因。它们通过将“重组”基因插入人体内发挥作用,通常用于治疗各种疾病,包括遗传疾病、癌症或慢性病。重组基因是在实验室中创建的一段DNA,将不同来源的DNA结合在一起。(2)体细胞疗法药物:包含经处理改变了其生物学特性的细胞或组织,这些细胞或组织不被用作人体内相同的基本机能而被用来治疗、诊断或预防疾病。(3)组织工程药物:含有经过修饰的细胞或组织,因此可用于修复、再生或取代人体组织。此外,一些ATMPs可能含有一种或多种医疗装置作为药物的组成部分,它们被称为组合ATMPs。EMA为规范和指导研究、开发和生产ATMPs,发布了科学的指导原则、合规标准和激励ATMPs发展的措施,具体见表4。
| 图表编号 | XD0087284800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.15 |
| 作者 | 王晴晴、王冲、黄志红 |
| 绘制单位 | 中国医药工业信息中心、上海药品审评核查中心、中国医药工业信息中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式