《表4 药物临床研究阶段FDA和EMA规定的基因毒性杂质可接受的限度》
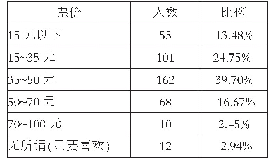
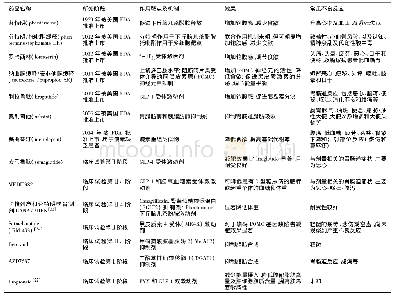
2004年EMA发布的基因毒性杂质限度指南(草案),采用“最低合理可行”的概念,默许全面消除风险是无法实现的,因此建议采用毒理学关注阈值TTC作为基因毒性杂质的可接受限度[16]。TTC概念的应用允许在无任何体内数据时,在足够的安全性基础上建立杂质控制限度。TTC的应用有利于企业和监管机构,使其避免做不必要的毒理学研究和安全性评估。然而,该草案没有明确短期临床试验的允许限度,在某些短期临床研究中,也被迫接受TTC的终生暴露限值。因此,在行业发展的要求下,“阶段化TTC”概念也应运而生[19]。美国药物研究和制造商协会在2006年开发了一套基因毒性杂质检测、分类、界定和独立风险评估的程序。根据积累剂量定义暴露风险的原则,提出了阶段化TTC概念,见表3和表4。
| 图表编号 | XD0012201500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.12.15 |
| 作者 | 汪生、杭太俊 |
| 绘制单位 | 安徽医科大学科研实验中心、中国药科大学药物分析系 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式