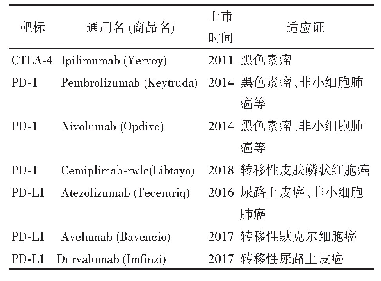
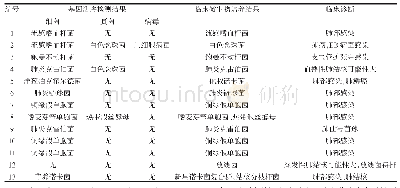
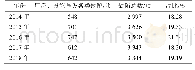
《表2 CFDA飞行检查与FDA、EMA相关检查微生物状况比较》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《2014~2018年药品生产飞行检查中的常见微生物问题分析与对策探讨》
注:a表示两项,前者为无菌项,后者为微生物限度项;/表示未进行微生物风险评估。
CFDA飞行检查与FDA、EMA相关检查微生物状况比较结果见表2。FDA警告信、EMA不符合项报告和CFDA飞行检查通报都是依照GMP的要求对药品生产中存在的问题进行检查后发布的,检查结果具有共性特征。综合分析全球药品生产中的微生物问题具有普遍性,比较FDA发布的警告信、EMA发布的不符合项报告与CFDA发布的飞行检查问题通报中的微生物问题[11~13],发现在药品生产和相关的召回中微生物问题较为突出,主要表现在人员、方法、测量、环境和管理等方面,无菌产品的召回主要体现在缺乏无菌保证,非无菌产品召回主要是细菌污染(洋葱伯克霍尔德菌、假单胞菌属或Ralstonia picketti等),其次是霉菌和酵母菌污染。尽管各方GMP要求不尽相同,归类的标准存在差异,检查重点和深度的差异可能导致分析数据存在偏差,但结果对于揭示药品生产中的微生物问题的本质仍具有借鉴意义,特别是对于制药过程中微生物控制的突出问题和共性问题应受到药品生产和监管部门的重视。
| 图表编号 | XD0049549800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.05 |
| 作者 | 李辉、杨静、贾萌、杨晓莉、绳金房 |
| 绘制单位 | 陕西省食品药品监督检验研究院、陕西省食品药品监督检验研究院、陕西省食品药品监督检验研究院、陕西省食品药品监督检验研究院、陕西省食品药品监督检验研究院 |
| 更多格式 | 高清、无水印(增值服务) |