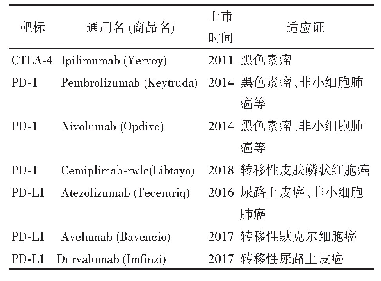
《表1 2016年FDA全球重点区域检查数据Tab.1 FDA Inspection Data in Global Key Regions in 2016》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《FDA-EU药品检查互认协议的推出对我国制药企业的影响》
继美国和欧盟正式签署MRA后,美国FDA将考虑把节约下来的检查资源重新布局到亚洲,尤其是中国和印度。美国FDA全球监管运营和政策代理副局长Corrigan曾于2017年5月5日在食品和药品法律研究所(FDLI)年会上表示,FDA-EU的MRA实施后将允许美国FDA对中国和印度制药企业执行的检查加倍,欧盟也将把大量检查资源从美国、美洲等国家和地区转移到亚洲;另外对位于欧盟境内的印度和中国制药企业的生产场地检查会参考官方行动(Official Action Indicated,OAI)的检查结果。2016年FDA的全球重点区域检查数据结果展示了FDA-EU的MRA实施后如何帮助FDA将检查重点转移到高风险区域[5],详见表1。
| 图表编号 | XD0062800600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.10 |
| 作者 | 范琳琳、梁毅 |
| 绘制单位 | 中国药科大学国际医药商学院、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |