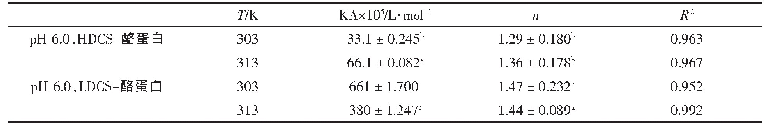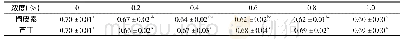《表2 未结合和结合槲皮素的β-乳球蛋白B的CD和FTIR光谱参数》
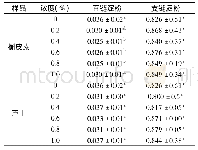
F T I R常用来测定蛋白质二级结构的变化,位于1 600~1 700 cm-1之间的酰胺I带,对于研究蛋白质的二级结构最有价值[4 1]。因此,本研究通过对酰胺I带的峰进行拟合推测β-乳球蛋白B二级结构的变化,通常情况下1 600~1 639 cm-1之间的峰为β-折叠的特征峰,1 640~1 650 cm-1为无规卷曲的特征峰,1 651~1 660 cm-1为α-螺旋的特征峰,1 661~1 700 cm-1为β-转角的特征峰[42]。从图7可以看出,在与槲皮素结合后,β-乳球蛋白B的拟合峰发生了明显变化。与结合前相比,位于1 600~1 639 cm-1范围内的峰明显增多,而位于1 651~1 660 cm-1范围内的峰则减少,这说明,结合槲皮素后β-乳球蛋白B中的α-螺旋含量降低,反之β-折叠含量增加,由表2可看出,α-螺旋减少了4.46%,β-折叠增加了3.59%。因此推测,槲皮素的结合使得部分α-螺旋解螺旋变为β-折叠。这与Jia Jingjing等[32]用β-乳球蛋白结合没表没食子儿茶素没食子酸酯、绿原酸和阿魏酸所得的结果相一致,即与多酚的结合诱导β-乳球蛋白中的α-螺旋解螺旋变为β-折叠。
| 图表编号 | XD0075195500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.25 |
| 作者 | 李晓雷、郑丽丽、艾斌凌、郑晓燕、杨旸、杨劲松、盛占武 |
| 绘制单位 | 中国热带农业科学院海口实验站、海南大学食品科学与工程学院、中国热带农业科学院海口实验站、海口市香蕉生物学重点实验室、中国热带农业科学院海口实验站、海口市香蕉生物学重点实验室、中国热带农业科学院海口实验站、海口市香蕉生物学重点实验室、中国热带农业科学院海口实验站、海口市香蕉生物学重点实验室、海南大学食品科学与工程学院、中国热带农业科学院海口实验站、海口市香蕉生物学重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式