《表1 TALEN与CRISPR/Cas9在微藻研究中的研究实例》
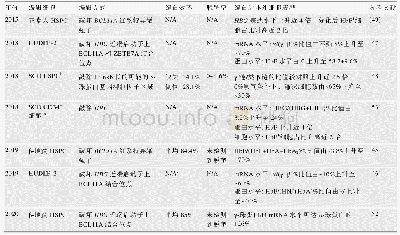
目前CRISPR/Cas9在微藻中的使用已经逐渐成熟。近期,Ajjawi等[34]优化了实验方法,使用电转化法将两个分别表达Cas9蛋白和外源插入基因的载体以及体外合成的sgRNA共转入微拟球藻(Nannochloropsis gaditana)细胞。使用这一流程分别成功敲除了N.gaditana的18个潜在的油脂合成负调控因子。通过代谢分析发现其中ZnCys突变体的碳向脂质的分配从20%上升到了40%~55%,并在进一步研究中获得了一种油脂产量两倍于野生型的工业藻株。从已有研究(如表1)可以看出,TALEN技术目前在微藻研究中应用较少,主要在硅藻P.tricornutum中获得成功,但其基因编辑的成功率相当高,突变子可达到克隆总数的50%。虽然TALEN技术需要设计表达特异性TALEN蛋白,相比CRISPR技术需要设计表达的sgRNA在实验设计上更有难度,更花时间,而且实验成本高,但其较高的成功率可大大减少载体转化、筛选突变的重复过程,也可显著缩短试验周期。由于CRISPR/Cas9技术的简易性,其在微藻研究中获得成功的尝试更多,如在C.reinhardtii、P.tricornutum、N.gaditana等多种微藻的研究中都成功实现了稳定的基因编辑。但以上研究中CRISPR/Cas9技术敲除基因的成功率也明显低于TALEN技术。在硅藻中应用CRISPR/Cas9技术还可能存在以下挑战:(1)出现SNP和indels(插入/删除)频率较高;(2)组成型表达的Cas9蛋白能够导致小的indel(1-2 bp)发生重编辑事件;(3)随着培养时间的延长整合进染色体的Cas9载体可能由于基因转换而发生丢失。尽管如此,CRISPR/Cas9技术最明显的优势在于编辑多个基因时,只需要改变针对目标基因改变人工设计的sgRNA即可,并且同时使用不同的sgRNA还可以实现多基因的同时敲除[35]。而TALEN技术需要针对不同基因分别设计表达上下游两个特异TALEN蛋白。所以,如果CRISPR/Cas9在微藻基因编辑研究的成功率得到提高,将更易于大量的基因编辑。
| 图表编号 | XD0062675700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.01 |
| 作者 | 郝夏晖、黄凤洪、龚阳敏 |
| 绘制单位 | 中国农业科学院油料作物研究所、农业部油料作物生物学与遗传重点实验室、中国农业科学院油料作物研究所、农业部油料作物生物学与遗传重点实验室、中国农业科学院油料作物研究所、农业部油料作物生物学与遗传重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式