《表5《第一批罕见病药品目录》相关治疗药品上市注册及医保纳入情况》
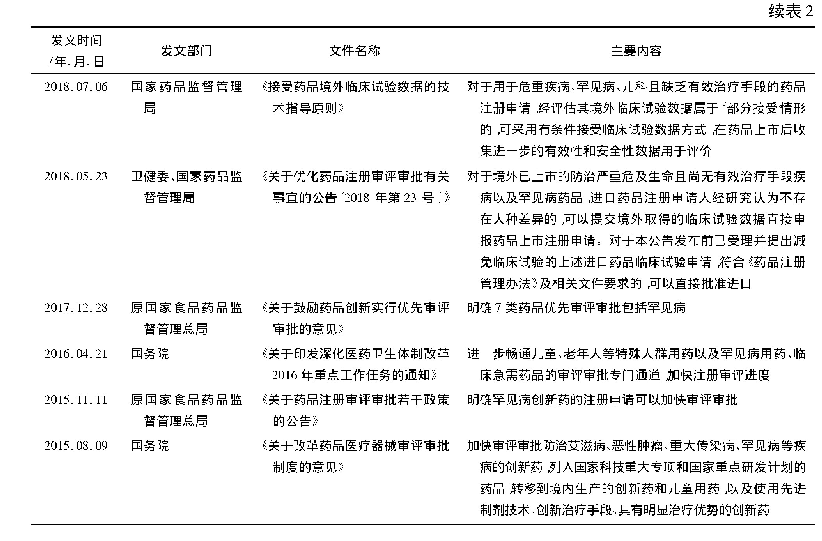
美国、欧盟、日本等发达国家已先后建立了比较健全的孤儿药政策法律体系。美国1983年就颁布了《孤儿药法案》(ODA),并于同年成立了美国罕见病组织(NORD),为推动和资助相关研究、教育和合作提供便利[29]。欧盟1997年成立欧洲罕见病组织,旨在改善欧洲罕见病患者的生命质量,并于1999年在《孤儿药管理法规》规定了孤儿药的界定标准及相应管理政策,同时成立罕见病专家委员会(EUCERD)[30]。此外,欧洲药品管理局(EMA)也专门设立了孤儿药委员会来保障罕见病用药。亚洲邻国日本也于1999年出台了罕见病用药政策。近年来,随着我国经济与社会的发展,对罕见病的重视也逐渐提高,国务院以及国家食品药品监督管理总局也相继出台了一些鼓励孤儿药研发创新、对临床急需的孤儿药实行优先审评审批等的保障政策。2016年底,由北京协和医院牵头,联合全国20家具有罕见病资源的医院,启动了“罕见病临床队列研究”项目。2018年10月24日,中国罕见病联盟在北京成立,推动罕见病研究方面取得重大突破,提升罕见病防治与保障水平,促进了罕见病与孤儿药开发的协同创新;2019年2月,公布第一批罕见病药品清单,减低罕见病药品增值税。在这些政策的助推下,我国罕见病研究和防治事业将加速驶入快车道。但《第一批罕见病目录》中仍有21种罕见病面临境外有药境内无药的困境,药物可及性低、负担重等问题依然存在,为进一步提升孤儿药的可及性,需要对进口孤儿药的审批提供更加便捷的服务,对创新孤儿药的研发给予更大的资金支持和税收减免,以提高企业的研发积极性。因此,建议国家成立专门的罕见病药品管理办公室,集中负责孤儿药的进口审批、孤儿药新药的注册审批以及孤儿药注册审批制度的制定,并对孤儿药的进口审批及注册审批实施差异化管理,从而加快新药进口和研发审批速度。为鼓励新药研发和本地化生产,给予企业研发费用资助并减低药品本地生产环节的增值税。另外,针对美欧日等国家对孤儿药的市场独占期,我国也可以考虑类似的做法来保证孤儿药的市场排他性,从而提高孤儿药的可及性,保障罕见病患者的合法权益。
| 图表编号 | XD00228909400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.08 |
| 作者 | 唐彦、张学杰、刘鑫、梅丹、付强、李建涛、张谦、张鹏霄、左玮、张波 |
| 绘制单位 | 中国医学科学院北京协和医院药剂科、青岛市黄岛区人民医院药剂科、中国医学科学院北京协和医院药剂科、中国医学科学院北京协和医院药剂科、中国医学科学院北京协和医院药剂科、中国医学科学院北京协和医院药剂科、中国医学科学院北京协和医院药剂科、中国医学科学院北京协和医院药剂科、中国医学科学院北京协和医院药剂科、中国医学科学院北京协和医院药剂科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

![表6 青岛市、浙江省、上海市罕见病药品的资金来源及保障范围[30]](http://bookimg.mtoou.info/tubiao/gif/ZGYX202011019_03100.gif)