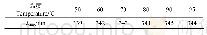
《表1 离子液体在不同温度下木瓜蛋白酶荧光光谱最大吸收波长处荧光强度》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《[C_4mim]BF_4、[C_4Py]Cl离子液体与木瓜蛋白酶相互作用的荧光光谱分析和分子对接》
注:肩标小写字母不同表示差异显著(P<0.05)。
荧光光谱法是在接近实际萃取环境下研究活性小分子与酶间相互作用应用最广泛的方法,其基于小分子引起的酶蛋白内源荧光光谱变化来获得二者的结合常数、结合位点数及热力学参数等信息[20-21]。由图1可知,随着离子液体溶液添加量的增加,木瓜蛋白酶的荧光强度呈规律性降低,表明二者发生了相互作用。采用Stern-Volmer方程(公式(1))分析不同温度下的荧光光谱最大吸收波长(表1),获得相应的猝灭常数(表2)。不同温度下的猝灭常数(Kq)均大于生物大分子动态荧光猝灭的最大常数2×1010 L/(mol·s),表明离子液体通过与木瓜蛋白酶结合成复合物,引发了酶蛋白的静态荧光猝灭[22]。
| 图表编号 | XD00207477900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.15 |
| 作者 | 田康永、杨吕清、胡慧慧、张海德 |
| 绘制单位 | 海南大学食品科学与工程学院、海南大学食品科学与工程学院、海南大学食品科学与工程学院、海南大学食品科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |