《表5 警告信问题按人用药品注册技术要求国际协调会议(ICH)药物临床试验质量管理规范(GCP)条款分类》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《美国食品和药物管理局发布的临床试验研究者警告信分析》
*:另有2条问题无法对应ICH GCP条款未做纳入
ICH GCP与美国FDA的GCP有一定差异,ICH GCP第四部分为研究者相关内容,共有13项。警告信中的257个问题项涉及ICH GCP条款11项,有16个问题项违反2项以上的ICH GCP条款,另有2个问题项(“您未能履行研究者的总体职责”和“您未能对IND下开展的临床研究进展情况进行监查”)因无法明确对应到ICH GCP具体条款而在本研究中未做归类,累计违反ICH GCP条款302次。警告信中问题项涉及ICH GCP条款数量最多的前三项分别是“4.5研究者遵从试验方案”(29.5%)、“4.9研究者的记录和报告”(20.9%)、“4.8受试者的知情同意”(18.9%),这三项发生率占总数的69.3%,见表5。
| 图表编号 | XD00199078400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.25 |
| 作者 | 孙搏 |
| 绘制单位 | 上海药品审评核查中心 |
| 更多格式 | 高清、无水印(增值服务) |


![表1 PDCA循环理论实施后药物临床试验质量问题发生情况的比较[n(%)]](http://bookimg.mtoou.info/tubiao/gif/ZGUD202033054_02100.gif)
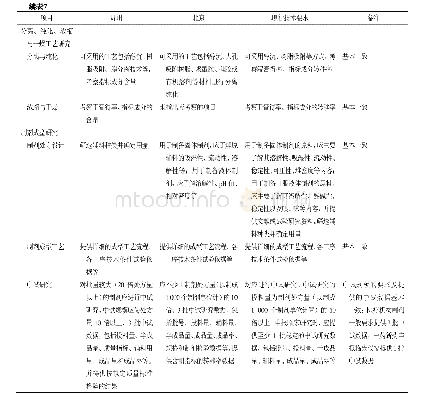
![表2 欧盟药物临床试验质量管理规范(GCP)检查员会议覆盖主题[7,8]](http://bookimg.mtoou.info/tubiao/gif/XYYL202007007_01300.gif)
![表1 欧盟药物临床试验质量管理规范(GCP)检查员工作研讨会主题[6-8]](http://bookimg.mtoou.info/tubiao/gif/XYYL202007007_01000.gif)