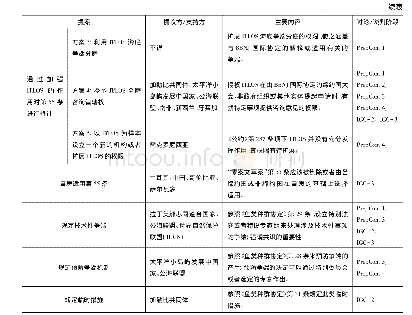
《表2 国际协调委员会(ICH)的生物标志物鉴定程序》
不同的监管机构所建立的生物标志物鉴定程序的重要性是明确和相似的。生物标志物的鉴定程序已经在美国、欧洲和日本(FDA、EMA和PMDA)的监管机构获得了共识和接受。虽然这些程序有相似的范围和目标,但是其复杂性和成本相差较大详见表2。人用药品注册技术要求国际协调会议(International Council for Harmonization,ICH)是一个对成员国家(美国,日本和欧盟,2018年6月中国加入ICH)人用药品注册技术规定的现存差异进行协调的国际协调组织,通过寻求解决三方国家之间存在的不统一的规定和认识,通过协调逐步取得一致,为药品研究开发、审批上市制定统一的国际性指导标准,以便更好地利用人、动物和材料资源,减少浪费、避免重复,加快新药在世界范围内开发使用;同时采用规范的统一标准来保证新药的质量、安全性和有效性,体现保护公共健康的管理责任。ICH生物标志物资格鉴定程序文件于2010年定稿,于2011年由FDA、EMA和PMDA公布。为了努力统一FDA、EMA和PMDA鉴定的提交格式,这是迄今为止发布的唯一的一个生物标志物鉴定统一性文件。具体使用情况、证据标准和该程序本身也需要统一。
| 图表编号 | XD00177045200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.04.28 |
| 作者 | 谢媛媛、张涛、贺浪冲、宋宗华、罗国安 |
| 绘制单位 | 清华大学化学系、西安交通大学药学院、西安交通大学药学院、国家药典委员会、清华大学化学系 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式