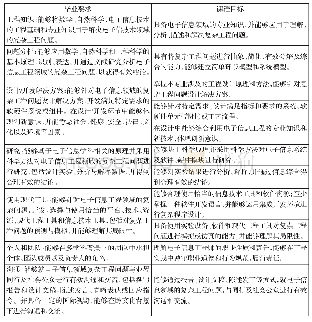
《表1 ICH M4Q与2007年版申报资料要求的对应关系》
与07版法规申报资料要求比较,M4Q文件最大特点是将原液与制剂的内容分开,条目更加细化,整体上ICH M4Q能与07版法规的7~15号资料对应。对于生产用原材料,07版法规要求在8号资料中以1份相对独立的资料呈现,并放在正式研究资料的最前面,而在CTD中则要求放在S.2.3原液生产项下,因此,在撰写及审评资料时需进行思维上的转化或适应;另外,CTD文件增加了3.2.A.1设施及设备的内容,且将3.2.A.2外源因子安全性评价的内容单独列出,07版法规要求在8、9及11号资料相应的部分呈现。现行的生物制品申报资料拆分整理后可与M4Q文件对接,二者具体对应关系见表1。
| 图表编号 | XD00155034200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.20 |
| 作者 | 周莉婷、白玉 |
| 绘制单位 | 国家药品监督管理局药品审评中心、国家药品监督管理局药品审评中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式