《表1 TGase处理前后差示扫描量热分析》
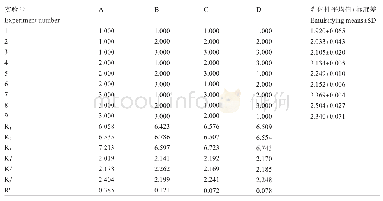
由图3可以看出,T G a s e作用后的变性温度和热焓值都有所提高,交联前S P I的变性温度为(7 3.7 5±0.1 3)℃,交联后变性温度为(76.30±0.22)℃。变性温度提高反应蛋白的热稳定性,说明交联后SPI热稳定性有所提高。热焓值交联前为(176±0.52)J/g,交联后热焓值为(193±0.32)J/g,热焓值能反映蛋白质的疏水性和聚集程度,热焓值提高,原因可能是酶交联后蛋白侧链上特定基团交联形成更大的分子,产生了大量的高能异肽共价键,从而使产物的热稳定性提高,与Jiang Shujuan等[19]研究结果相一致。从这一结论可以看出交联可能产生了异肽共价键,热稳定性升高,凝胶强度增强。
| 图表编号 | XD00123440300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.12.25 |
| 作者 | 臧学丽、陈光 |
| 绘制单位 | 长春医学高等专科学校、吉林农业大学生命科学学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式