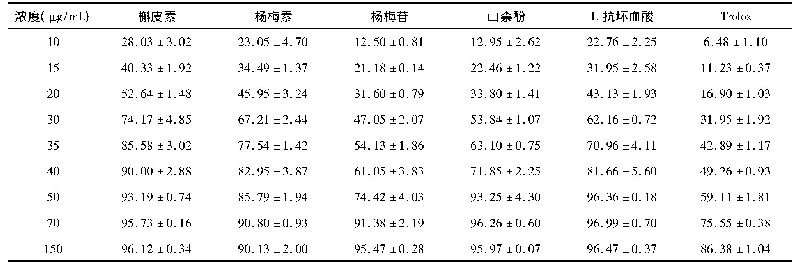
《表2 杨梅素、杨梅素/G-β-CD包合物的DPPH自由基清除率》
DPPH乙醇溶液在波长517 nm处有强的吸收峰,溶液呈紫色[31]。DPPH自由基的孤电子可以与自由基清除剂提供的电子配对,使其最大吸光度下降而褪色,而且褪色程度与其接受的电子多少相关,即自由基清除剂的清除自由基能力越强,褪色程度越高,吸光度越小。环糊精在517 nm波长处无吸收,因而不会对包合物清除DPPH自由基的分析造成干扰[26]。在杨梅素浓度为2~10 mmol/L的范围内,对杨梅素与杨梅素/G-β-CD包合物的DPPH自由基清除能力做3组平行实验。随着杨梅素浓度增加,杨梅素/G-β-CD包合物DPPH自由基清除率随之增加。由表2可知,在相同的杨梅素浓度下,杨梅素与杨梅素/G-β-CD包合物的清除DPPH自由基能力有明显不同,且随着杨梅素浓度增加,这种差异越来越明显。在测定浓度范围内,杨梅素DPPH自由基清除率从21.75%增加到37.06%,杨梅素/G-β-CD包合物DPPH自由基清除率则从27.14%提高到77.50%,杨梅素浓度为10 mmol/L时,杨梅素/G-β-CD包合物与杨梅素相比,DPPH自由基清除率增大了109.12%,说明通过包合作用,杨梅素的DPPH自由基清除能力显著提高。推测原因可能是杨梅素被包合到环糊精腔体内后,增大了杨梅素的稳定性使其易与DPPH自由基反应[32],而且杨梅素的酚羟基与环糊精的羟基易形成分子内氢键,使包合物的羟基化程度增大而提高了包合物的抗氧化能力[33]。
| 图表编号 | XD00123387800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.25 |
| 作者 | 王轶博、符晓芳、袁丽、张婷、辛婷婷 |
| 绘制单位 | 北京工商大学理学院、北京工商大学理学院、北京工商大学理学院、北京工商大学理学院、北京工商大学理学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式