《表9 硼酸衍生物对FAP抑制IC50》
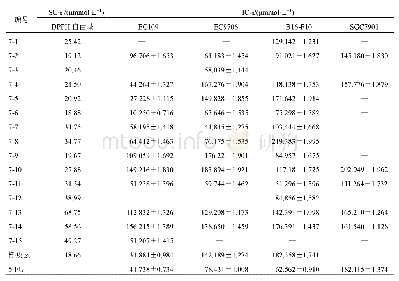
Tran等[85]以硼酸结构(boroPro)为基础设计了系列衍生物(图3),当固定R3为氢原子,绝大多数R2取代基(例如环戊烷、环己烷和苯环)衍生物对FAP都具有较好的选择性.在R2苯环取代衍生物上引入氯原子能显著增强FAP和DPP4亲和力.化合物3-1作为最优构象,与FAP具有强亲和力(Ki=7.5 nmol/L),是DPP4的3 000多倍.但在该实验中,系列衍生物对脯氨酰内肽酶(prolyl endopeptidase,PREP)的亲和力未被研究,有关FAP选择性还需进一步研究.FAP和PREP同属于二肽基肽酶,不同的是PREP主要发挥内肽酶活性,而FAP除具有内肽酶活性外,还具有外肽酶活性.Poplawski等[86]也设计了相同硼酸结构为基础的系列衍生物,并分别鉴定出FAP和PREP特异性抑制剂.如表9所示,化合物3-2对FAP显示出强效的抑制作用,相比于PREP强约360倍,而化合物3-3对除PREP之外的其他二肽基肽酶几乎无抑制作用,两者对相应的靶酶都具有良好的选择性.R1的甘氨酸取代衍生物对FAP有更强的选择性,其抑制活性约为PREP的900倍,但是由于甘氨酸上游离N端的存在,甘氨酸取代衍生物对二肽基肽酶家族其他成员也有明显的抑制.当引入哌啶环作为N端封闭集团(R2),该问题得以明显改善,因此游离N端的封闭对内肽酶活性的选择性是必不可少的.同时,在哌啶环上引入卤素原子(Cl和F),化合物对FAP与PREP的抑制能力都明显加强,这与Tran等的实验结果相符合.除此以外,D-丙氨酸取代甘氨酸可以增强内肽酶的活性.通过改变哌啶环中氮原子的位置以及引入异丙基替换D-丙氨酸上的甲基(R3),化合物对FAP的亲和力大幅降低,而PREP活性明显提高.除了上述实验外,Lee等[70]在化合物3-4(Ac-Gly-boroPro)的乙酰基和甘氨酸中引入8-氨基-3,6-二氧杂辛酸(peg),增强了化合物对FAP的亲和力(Ki=0.8±0.2 nmol/L),相比于DPP4(Ki=440±29 nmol/L),加强了对内肽酶活性的选择性.
| 图表编号 | XD00122704600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.20 |
| 作者 | 孙朝晖、邹立伟、杨凌 |
| 绘制单位 | 上海中医药大学交叉科学研究院、上海中医药大学交叉科学研究院、上海中医药大学交叉科学研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式