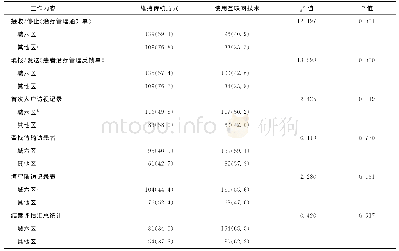
《表1 不同管理机构对临床研究方案重要结构内容要求比较分析》
注:*2018年7月17日国家市场监督管理总局公布了最新《药物临床研究质量管理规范(修订草案征求意见稿)》,但截止到目前我国现行GCP标准为2003年颁布版本,故本研究沿用2003年GCP版本要求;○表示有,×表示无。
本研究参考如下标准对干细胞临床研究方案进行评估:(1)我国现行《药物临床研究质量管理规范(SFDA-GCP)2003版》[8];(2)人用药品技术要求国际协调理事会《药物临床研究质量管理规范E6(R1)》[The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,GUIDELINE FOR GOOD CLINICAL PRACTICE E6(R1),ICH GCP E6(R1)][9];(3)《干细胞临床研究管理办法(试行)》(国卫科教发[2015]48号)[10]。表1总结了不同机构对临床研究方案主要结构内容的要求,从比较的结果来看,总体要求基本一致,这些要求主要针对II/III期临床研究,但对于I期或早期探索性临床研究方案的设计也具有参考价值。
| 图表编号 | XD0087929500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.10 |
| 作者 | 谢丽、路茂杰、沈力、宋雪霏、吴朝晖、钱碧云 |
| 绘制单位 | 上海交通大学医学院临床研究中心、上海交通大学医学院公共卫生学院、上海交通大学医学院公共卫生学院、上海交通大学医学院附属第九人民医院眼科、中国医药生物技术协会、上海交通大学医学院临床研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式