《表2 抑制剂对HTS突变体的影响[28]》
![《表2 抑制剂对HTS突变体的影响[28]》](http://bookimg.mtoou.info/tubiao/gif/SPKX201911038_02700.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《蛋氨酸特异性合成途径关键酶——高丝氨酸O-酰基转移酶的研究进展》
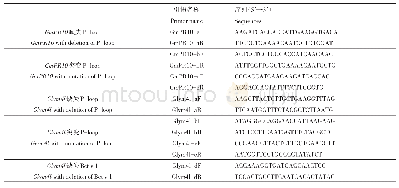
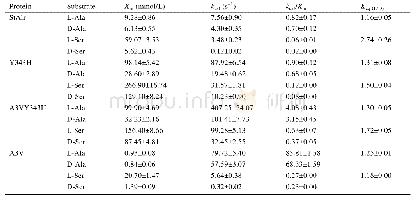
反馈抑制是蛋氨酸合成过程中基本且快速的调节方式,避免代谢物过量积累影响代谢平衡。E.coli是工业生产的模式菌株,E.coli中HTS受蛋氨酸和S-腺苷蛋氨酸(S-adenosyl methionine,SAM)的协调反馈抑制,1 mmol/L蛋氨酸或1 mmol/L S-腺苷蛋氨酸浓度条件下,HTS活力仅为4%或13%[28]。2005年,Usuda等[28]将E.coli W3110中HTS的R27、I296和P298分别替换为Cys、Ser和Leu,部分解除了蛋氨酸和S-腺苷蛋氨酸的反馈抑制作用,在浓度为100 mmol/L的蛋氨酸或1 mmol/L的S-腺苷蛋氨酸条件下相对酶活力可保持在80%以上,虽然减弱了HTS受到的反馈抑制,但突变后酶活力比野生型HTS更低,仍需进一步研究在保证酶活力的基础上解除反馈抑制(表2)。即便HTS突变后酶活力降低,Usuda等[28]的研究仍为随后改造蛋氨酸合成途径的研究提供参考,Liu Qian等[25]在E.coli中过量表达该解除反馈抑制的HTS(R27C、I296S、P298L)并敲除MetJ和过表达运输蛋白YjeH,使蛋氨酸产量达到1.7 g/L。2015年,段昭炜[36]经定点突变后筛选出抗反馈抑制的突变体(Y299C),在1 mmol/L蛋氨酸或1 mmol/L S-腺苷蛋氨酸存在的情况下酶活力分别为86.3%及79.6%。此后关于该酶反馈抑制解除的研究鲜有报道,但可以看出HTS所受的反馈抑制没有完全解除。相比于解除反馈阻遏来提高酶表达量,通过解除反馈抑制提高酶活力的方法更省时,能耗更少,能更加有效地催化高丝氨酸。因此仍需更进一步对酶的抑制剂结合位点进行研究,提高该酶在抑制剂存在情况下的活力。
| 图表编号 | XD0075143200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.15 |
| 作者 | 刘诗梦、韩彩静、高云娜、赵兰、卢红妍、闵伟红 |
| 绘制单位 | 吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室 |
| 更多格式 | 高清、无水印(增值服务) |