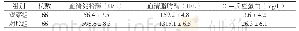《表2 游离酶与碱性蛋白酶CLEAs的动力学参数》
a:最优反应条件为p H值7.5,60℃;b:最优反应条件为p H值8.0,65℃。
通过测定不同浓度酪蛋白在各最佳反应条件下(游离酶pH值7.5,60℃;CLEAs pH值8.0,65℃)的初始反应速率,比较了游离酶和碱性蛋白酶CLEAs的表观动力学参数,见表2。CLEAs的Km值(2.3mg/m L)低于游离酶(3.6 mg/m L),说明CLEAs对底物的亲和力增强。CLEAs的Vmax为9.8 mg/(m L·min),低于游离酶的13.3 mg/(m L·min)。酶通过固定化后会造成其构象发生变化,使酶的活性位点更适合与底物结合[28]。CLEAs的催化效率(Vmax/Km)高于游离酶(3.7 min-1),说明CLEAs具有更高的催化效率。游离酶的活性位点具有不同的走向,但经过交联固定化后,酶的活性位点排列有序,更容易与底物结合,效率更高。
| 图表编号 | XD0052195300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.05.25 |
| 作者 | 区晓阳、曾英杰、彭飞、倪子富、熊隽、宗敏华、娄文勇 |
| 绘制单位 | 华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南协同创新研究院生物活性分子开发与应用创新中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式