《表6 酶法制备乳清蛋白膜性能正交试验L9(34)分析及评价》
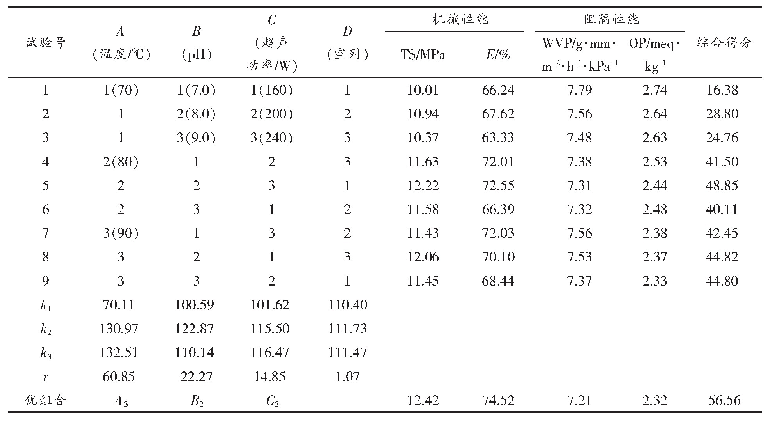
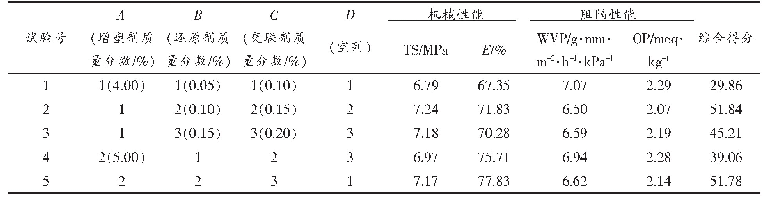
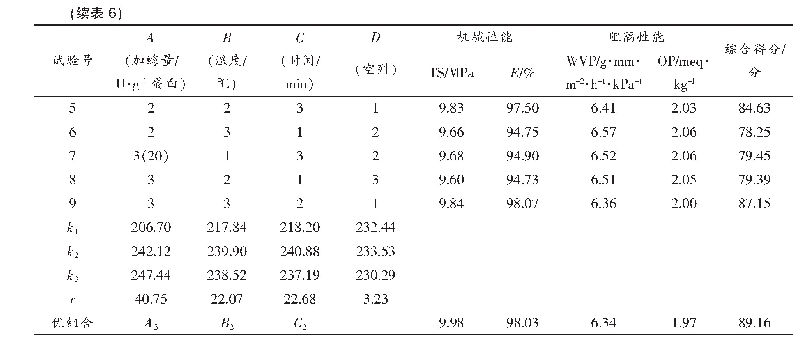
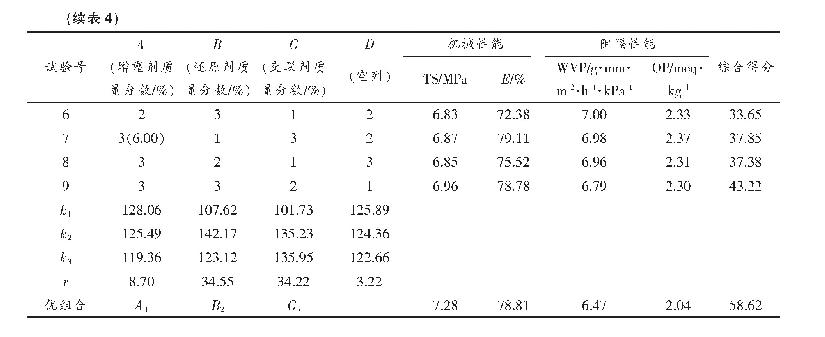
在前期单因素试验基础上[16],考虑交互作用做正交试验L9(34),通过加权分析对酶法制备乳清蛋白膜的综合性能进行评分(表6),主次关系依次为A(加酶量)>C(时间)>B(温度)。TG酶能催化蛋白质分子间或分子内形成ε-(γ-谷氨酰基)赖氨酸共价键,蛋白质共价交联,有利于乳清蛋白膜形成三维网状结构,增强膜的机械性能和阻隔性能[25-27]。随TG酶量的增加,机械性能及阻隔性能均增强,大于15 U/g蛋白的膜性能无显著增加,说明酶与蛋白活性中心最大程度结合。温度过低或过高,均影响TG酶活性和乳清蛋白展开的状态,导致蛋白膜间交联程度不同。并且随酶解时间的延长,酶交联反应越充分,蛋白分子交联越多,形成的蛋白空间网络结构更紧密。
| 图表编号 | XD00216360700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.31 |
| 作者 | 王莹、刘晶晶、张飞飞、姜淑娟、牟光庆、钱方 |
| 绘制单位 | 大连工业大学食品学院、大连工业大学食品学院、大连工业大学食品学院、大连工业大学食品学院、大连工业大学食品学院、大连工业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式