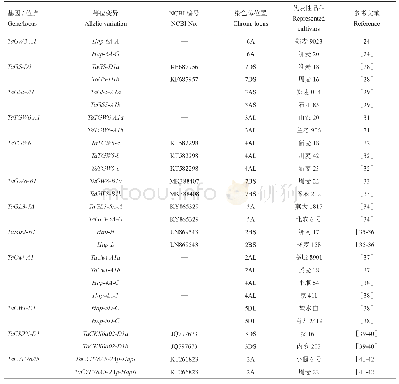
《表2 PD相关基因的变异类型》
Parkin基因,定位于染色体6q25.2-q27,含有12个外显子,编码的Parkin蛋白含465个氨基酸。目前发现Parkin基因突变会导致其功能丧失(见表2),不能正常降解底物。Parkin敲除小鼠早期多巴胺能神经退行性病变和运动缺陷的发生被促进,但并未使病理恶化[11]。PINK1基因,定位于染色体1p36,包含8个外显子,全长1.8 kb,编码的PTEN诱导激酶1,位于线粒体膜上,与Parkin基因编码的E3泛素连接酶共同作用线粒体,参与线粒体自噬[12]。在2008年的一项研究中,观察到解偶联剂羰基氰化物间氯苯腙(CCCP)处理后,大量Parkin从胞浆移位到受损的线粒体,通过磷酸化激活Parkin,线粒体随后通过自噬方式去除。最近,在Parkin基因敲除小鼠中也发现在其DA神经元中,线粒体破碎,内部结构异常积累[13]。Parkin介导的受损线粒体清除途径需要PINK1,涉及Parkin-α-syn相互作用和泛素化,这些发现将这3个关键的PD基因与线粒体应激反应中的线粒体结构异常联系起来。在PD患者中,α-syn过表达会引起线粒体复合体I活性下降和ROS生成增加,导致线粒体应激。线粒体损伤时的膜电位(ΔΨm)减少,导致PINK1通过线粒体膜外的自动磷酸化积累和激活,该磷酸化位点在哺乳动物细胞的研究表明,PINK1可以在残基S228和S402处自动磷酸化,而在果蝇中S346残基上是唯一的PINK1自动磷酸化位点[14]。磷酸化之后可进一步阻止依赖ΔΨm的PINK1进入线粒体内部隔室,而此时,Parkin会迅速移位到线粒体,通过PINK1和Parkin泛素化调节线粒体自噬介导的线粒体消除作用,清除受损的线粒体[15]。PINK1还能通过诱导自噬作用将α-syn降解[3]。然而,慢性线粒体应激或Parkin或PINK1基因突变引起的α-syn的长时间或者无节制激活会导致线粒体过度分裂、线粒体功能衰竭,最终导致神经细胞死亡和PD。α-syn、PINK1和Parkin三者共同作用于线粒体上,揭示了这些基因在线粒体的应激反应中的功能,在未来α-syn的特定功能进一步被研究,能对PINK1/Parkin和PD方面的研究进一步加深。
| 图表编号 | XD00215959900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.02.28 |
| 作者 | 胡春波、杨颖、孙江萌、沈丽华 |
| 绘制单位 | 南通大学附属医院神经内科、南通大学附属医院神经内科、南通大学附属医院神经内科、南通大学附属医院神经内科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式


![表2 PD-1基因各位点基因型分布及与ESCC患者化疗疗效的相关性[例(%)]](http://bookimg.mtoou.info/tubiao/gif/LCZL202101004_16400.gif)