《表1 重组酶Cp CR的纯化》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《近平滑假丝酵母ATCC 7330羰基还原酶CpCR的表达及酶学性质研究》
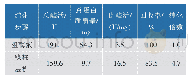
采用重组菌E.coli BL21 (DE3)-p ACYCDuet-1-cpcr在IPTG诱导下进行异源表达含有His标签的羰基还原酶Cp CR,按照1.2.2小节的方法经Ni-Agarose柱亲和层析纯化后,与重组菌菌体破壁上清液相比(图4),纯化后的目的蛋白条带较单一(图5泳道4)。洗脱液总蛋白含量为8.3 mg,比酶活力为20U/mg,总酶活力为168 U,总回收率为71%,纯化倍数为5.5(表1)。本研究比文献[6]报道的利用谷胱甘肽(glutathione,GST)作为标签表达的重组酶Cp CR分离纯化耗时少,效率高。
| 图表编号 | XD00209245800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.02.15 |
| 作者 | 宋婷、王帅静、汪沉、吕育财、罗华军、郭金玲、龚大春 |
| 绘制单位 | 中国轻工业功能酵母重点实验室(三峡大学)、三峡大学生物与制药学院、中国轻工业功能酵母重点实验室(三峡大学)、三峡大学生物与制药学院、中国轻工业功能酵母重点实验室(三峡大学)、三峡大学生物与制药学院、中国轻工业功能酵母重点实验室(三峡大学)、三峡大学生物与制药学院、中国轻工业功能酵母重点实验室(三峡大学)、三峡大学生物与制药学院、中国轻工业功能酵母重点实验室(三峡大学)、三峡大学生物与制药学院、中国轻工业功能酵母重点实验室(三峡大学)、三峡大学生物与制药学院 |
| 更多格式 | 高清、无水印(增值服务) |