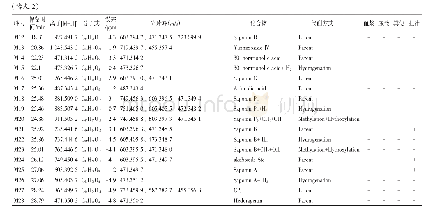
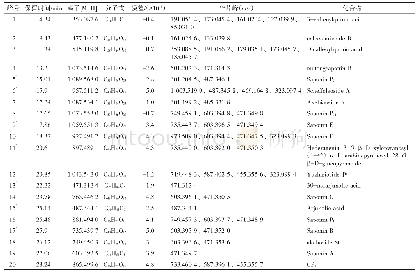
《表8 合成肽的色谱、质谱信息及α-淀粉酶的IC50》
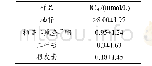
采用固相合成法合成了3条新发现的肽段,并验证了潜在α-淀粉酶抑制活性相似序列合成肽的效价。如图11A1、B1、C1所示,出峰时间稳定、峰形对称、基线平稳,纯度都大于95%。如图11A2、B2、C2所示,各肽的分子质量测定值与其理论值相近,合成结果可靠,具体数据见表8。HAGPTWNPISIGISFM、IPLPLPLPLP和LPLPLPLR三条肽的α-淀粉酶的IC50分别为0.067、0.039 mg/m L和0.041 mg/m L,都低于与之对应的酶解产物,造成这样结果的原因可能是合成肽仅为单一肽,而酶解产物中是多种混合肽的共同作用;合成肽的氨基酸序列和分子质量虽然与天然肽相近,但空间结构有所不同;此外合成过程中一些毒性物质的影响,也会对活性造成一定的破坏。HAGPTWNPISIGISFM的活性相对较低,IPLPLPLPLP和LPLPLPLR的活性相差不大,说明α-淀粉酶抑制活性与疏水性氨基酸有关,主要是亮氨酸和脯氨酸,验证了氨基酸序列与活性的相关性。
| 图表编号 | XD00195496200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.25 |
| 作者 | 苏娜、伊丽、吉日木图 |
| 绘制单位 | 内蒙古农业大学乳品生物技术与工程教育部重点实验室、内蒙古农业大学乳品生物技术与工程教育部重点实验室、内蒙古骆驼研究院、内蒙古农业大学乳品生物技术与工程教育部重点实验室、内蒙古骆驼研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式