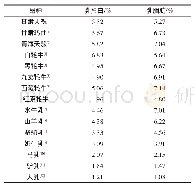
《表1 不同热处理温度下牛乳中乳球蛋白功能性质的变化》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《采用分子动力学模拟研究温度对乳球蛋白稳定性的影响》
注:常温,25℃;“-”表示无此实验条件下数据
乳球蛋白不仅营养价值丰富且具有优良的功能性质,在一定的温度下乳球蛋白的结构发生改变,进而引起其性质的变化。近年来,不同热处理温度牛乳中乳球蛋白性质研究总结如表1所示。从表1可以看出,由于在加热过程中蛋白质发生了变性导致聚集和沉降[27],乳球蛋白的含量和溶解度随着温度的升高而下降,在100℃已经有91%以上的乳球蛋白发生变性。乳球蛋白经过60℃加热后较常温的乳球蛋白的乳化性低75.55 m2/g,这是由于加热导致乳球蛋白聚合亲水性下降进而引起乳球蛋白乳化性降低[28]。RAHAMAN等[29]使用ANS作为荧光探针并用荧光法测定乳球蛋白表面疏水性,发现高温使乳球蛋白内部疏水基团暴露,乳球蛋白的表面疏水性随着温度升高而增大,并在100℃时增大至常温的2倍。乳球蛋白结构和生理功能的改变说明了乳球蛋白在70℃时开始发生变性,并随着温度的升高变性的程度增大。上述研究结果在一定程度上,与本文中采用的分子动力学模拟分析得出结论相一致。
| 图表编号 | XD00170933000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.04.15 |
| 作者 | 刘祥雨、覃小丽、钟金锋 |
| 绘制单位 | 西南大学食品科学学院、西南大学食品科学学院、西南大学食品科学学院 |
| 更多格式 | 高清、无水印(增值服务) |