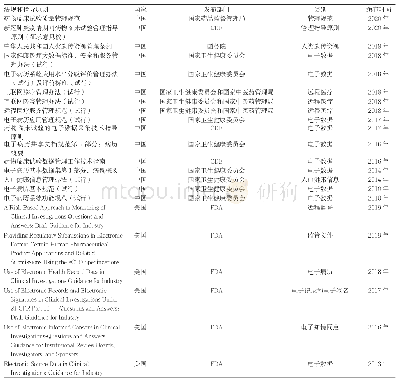
《表3 FDA对RMAT的指导原则》
FDA对细胞治疗的监管比较全面,从非临床研究到临床研究都发布了相关的指导原则,对某些疾病的细胞治疗也单独发布了指导原则,其中既有对行业的指导原则,也有对FDA审评人员的指南。此外,FDA还根据21世纪治愈法案(The 21st Century Cures Act)提出的再生医学先进疗法(regenerative medicine advanced therapy,RMAT)的概念,发布了新的指导原则和指导原则草案,具体见表3。RMAT是指药物根据公共卫生署法案第361条或者21CFR第1 271条中被定义为细胞疗法、治疗性组织工程产品、人类细胞和组织产品,或使用此类疗法或产品的任何组合产品;该药物旨在治疗、改变、逆转或治愈严重或危及生命的疾病或病症,以及初步临床证据表明,该药物有可能解决这种疾病或病症的未满足医疗需求[7]。
| 图表编号 | XD0087285100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.15 |
| 作者 | 王晴晴、王冲、黄志红 |
| 绘制单位 | 中国医药工业信息中心、上海药品审评核查中心、中国医药工业信息中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式


![表1 FAIR指导原则[32]](http://bookimg.mtoou.info/tubiao/gif/ZUZH202006005_20600.gif)