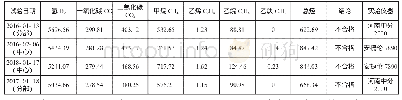
《表1 2016年134号与2017年146号文件下药用辅料监管制度的对比》
相比2016年134号文件中的规定,2017年146号文件对我国药用辅料监管的主要变化为:(1)增加在登记平台上的登记号。2017年146号文件规定相关企业在登记平台上完成登记后将发给登记号,但未明确是否与2016年第134号中企业在完成关联审评后发给的核准编号并存。(2)允许辅料企业独立提交材料。2017年146号文件不再强制要求辅料企业的资料与制剂企业的资料关联申报,其材料可在开展共同审评时单独提交。(3)扩大了共同审评的辅料范围。2017年146号文件规定各类药品制剂申请中所包含的辅料均需要参加共同审评,包含此前例外的进口制剂中使用的辅料,但对是否包含政策解读(一)中规定的不纳入关联审评的辅料等未作明确。(4)增加了对登记资料的完整性审查。2017年146号文件规定药审中心将会在企业完成登记后的五日内对资料进行完整性审查,而2016年134号文件中仅会对资料进行形式审查。(5)明确了年度报告的要求。2017年146号文件明确在登记平台上完成登记的企业应按年度提交产品质量管理报告。见表1。
| 图表编号 | XD0064292700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.28 |
| 作者 | 邹宜諠、陈云、邵蓉、周斌 |
| 绘制单位 | 中国医药工业研究总院、中国医药工业研究总院、中国药科大学、中国药科大学、中国医药工业研究总院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式