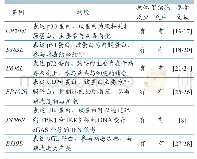
《表1 SIRTs分类以及功能》
Sirtuins属于高度保守的,具有NAD+依赖性去乙酰化酶活性的蛋白家族。酿酒酵母Sir2是这一家族最早发现的成员,之后又相继发现了Hst1-4(Imai等.2000)。酵母Sirtuins的高等哺乳动物同源蛋白共有7种,包括SIRT1-7。与酵母相同,SIRTs含有高度保守的核心结构域,因此,同样具备了NAD+依赖性去乙酰化酶的活性(Landry等.2000)(图1)。SIRTs根据250个氨基酸核心结构域的同源性,在系统发育上分为四个亚类,SIRT1,2和3被归为亚类I,这三者与酵母Sir2有着高度的同源性,表现出较强的去乙酰化酶活性。SIRT4和5分别属于亚类II和III;SIRT6和7被归为亚类IV(Frye等.2000)。目前已知的,由SIRT1催化的去乙酰化反应底物最多,其中又分为组蛋白和非组蛋白底物(表1)。与SIRT1相同,SIRT2和3也表现出较强的去乙酰化酶活性(表1)。SIRT5、6、7对底物同样可以去乙酰化,但催化底物的数量远小于前三者。然而,研究表明,SIRT5、6、7可以参与蛋白表达后期的其它修饰过程,包括蛋白质的核糖化,去丙二酰化,去琥珀酰化,去戊二酰化等。SIRT4一度被认为只具有ADP-核糖基转移酶活性,但Laurent等(2013)发现,SIRT4可以对丙二酰辅酶a (malonyl Co A decarboxylase,MCD)去乙酰化,来抑制其活性。MCD的作用是为脂肪合成提供碳骨架,也可参与抑制脂肪氧化。SIRTs具有各自不同的亚细胞定位,因此,进一步预示了这些蛋白将表现出各自不同的生物功能。SIRT1、SIRT6和SIRT7位于细胞核,但不同于后两者,SIRT1远离核仁以及异染色质区域。SIRT6位于核仁,且存在的位置与异染色质区域有高度的重叠。SIRT7位于核仁样小体,但GFP融合蛋白结果显示,其分布与SIRT6又有显著的不同。SIRT2最初被认为是细胞质蛋白,然而,后来的研究显示SIRT2也位于细胞核,并且参与细胞周期的调节(Serrano等.2013)。SIRT3、SIRT4和SIRT5存在于线粒体[1]。SIRTs不同的亚细胞定位以及底物的多样性,决定了SIRTs功能的多样化。大量研究表明,SIRTs通过调控胰岛素的分泌以及抵抗来调节人体葡萄糖代谢,而且这一过程是通过复杂的细胞内分子调控机制来实现的。此篇综述,我们将探讨SIRTs在2型糖尿病调控中的作用及其靶向治疗所具有的可行性。
| 图表编号 | XD00225364800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.25 |
| 作者 | 李鑫、李春喜、代唯、裴宇、张思嘉、高雪菲、李明光 |
| 绘制单位 | 吉林医药学院检验学院、吉林医药学院检验学院、吉林医药学院临床医学院附属医院、吉林医药学院检验学院、吉林医药学院检验学院、吉林医药学院检验学院、吉林医药学院检验学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式