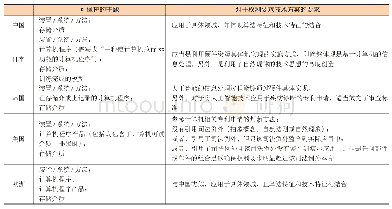
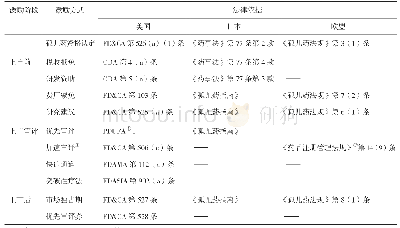
《表5 美日欧孤儿药独占期保护的不同情形》
注:(1) 7.5年=5年数据保护+30个月审评等待期。
根据Reg.(EEC)No1901/2006规定,满足儿科研究计划(PIP)条件的孤儿药上市后可延长2年市场独占期,共计12年市场独占期(表5)。
| 图表编号 | XD00216371700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.20 |
| 作者 | 李壮琪、许文秀、杨殿政、卫付茜、杨悦 |
| 绘制单位 | 沈阳药科大学工商管理学院、国际食品药品政策与法律研究中心、沈阳药科大学工商管理学院、国际食品药品政策与法律研究中心、沈阳药科大学工商管理学院、国际食品药品政策与法律研究中心、沈阳药科大学工商管理学院、国际食品药品政策与法律研究中心、沈阳药科大学工商管理学院、国际食品药品政策与法律研究中心、清华大学药学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式