《表2 虚拟突变结果:吉马烯A合酶的同源模建及分子对接》
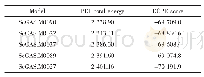
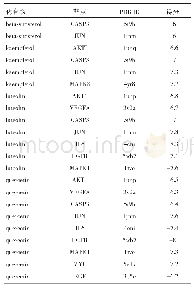
对23个潜在的关键氨基酸做437组饱和突变,分析突变前后蛋白热稳定性以及与底物FPP亲和力的变化,推测有16组突变(D301N、D302N、D302K、E379Q、E379L、G402M、E453I、E454Q、D526R、D526N、D526V、D526Q、D526C、D526T、D526L、D526Y)可提高蛋白的稳定性和亲和力.对比氨基酸突变前后蛋白与FPP的对接构象(如图4、图6),发现氨基酸突变后通过影响酶与底物作用的活性口袋的位置及大小、与底物的成键方式以及与辅助因子的作用力,间接影响酶的功能.结合SNAP2评分以及酶与FPP的对接构象,最后得到4组突变D301N、D302K、D526L及E379L(见表2).对倍半萜合酶催化机制及突变的研究表明[20],可塑性氨基酸的突变可通过影响酶的产物特异性提高产物的多样性,从而使酶的功能得到进化,有些突变亦可提高酶的催化效率.通过数据分析发现,D301N、D302K、D526L和E379L这4组突变不仅增强了蛋白的热稳定性、酶与底物的结合亲和力、使底物以“U”型构象与蛋白对接(如图6),而且对接的Lib Dock评分均比其他突变高30左右,表明该对接结果更容易发生,酶的表达产物中含有更多的吉马烯A.这些结果与体内实验是否一致,需要通过体外酶活实验进行验证.
| 图表编号 | XD00196556300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.30 |
| 作者 | 霍晋彦、曹洪玉、储晓慧、冯宝民、于宗霞 |
| 绘制单位 | 大连大学生命科学与技术学院、大连大学生命科学与技术学院、大连大学生命科学与技术学院、大连大学生命科学与技术学院、大连大学生命科学与技术学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式