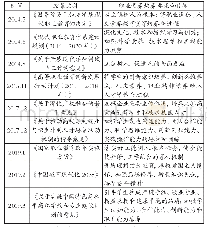
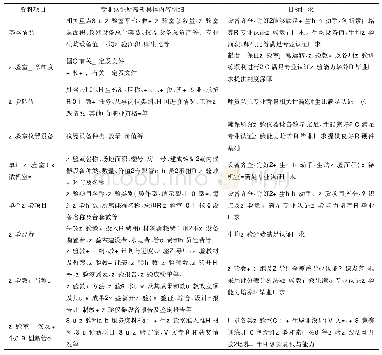
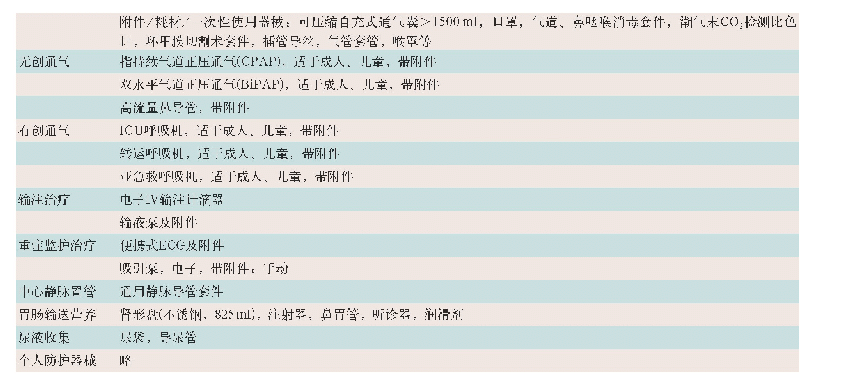
《表3 WHO预认证实验室相关的GMP文件和附加要求》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《WHO药品预认证微生物实验室质量管理的要求与思考》
WHO主要采用文件评估和现场核查两种方式对申请预认证的实验室是否符合GPCL(和/或GPML)要求做出判断。实验室还须满足WHO推荐的GMP相关要求。这些要求涉及方法转移、验证、无菌药品、非无菌制剂和制药用水等。在质量控制与检测的附加要求中还涉及检测报告模板、标准物质、药品储存、采样等。见表3。而我国药品微生物检测实验室主要根据《中华人民共和国药典》(以下简称《中国药典》)2015年版四部微生物相关标准和指导原则的要求,以及中国合格评定国家认可委员会(CNAS)认可准则和相关领域的应用说明开展检测业务。但上述文件的规定相较WHO的要求而言还比较笼统,许多操作性细节没有明确、统一的规定。同时,政府和第三方药品检测实验室也较少按GMP要求对验证过程、数据可靠性等进行有效的控制,这是我国检测实验室管理体系与WHO预认证实验室最大的差别所在。
| 图表编号 | XD00179758200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.04.20 |
| 作者 | 范一灵、秦峰、刘浩、顾颂青、杨美成 |
| 绘制单位 | 国家药品监督管理局药品微生物检测技术重点实验室上海市食品药品检验所、国家药品监督管理局药品微生物检测技术重点实验室上海市食品药品检验所、国家药品监督管理局药品微生物检测技术重点实验室上海市食品药品检验所、国家药品监督管理局药品微生物检测技术重点实验室上海市食品药品检验所、国家药品监督管理局药品微生物检测技术重点实验室上海市食品药品检验所 |
| 更多格式 | 高清、无水印(增值服务) |