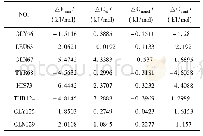
《表2 能量分解的主要贡献残基各部分能量值》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《基于分子模拟技术研究来源于嗜热地衣芽孢杆菌葡聚糖酶的活性位点》
为了进一步研究小分子UNK与葡聚糖酶分子间的相互作用模式,通过利用MM-PBSA程序计算每个氨基酸残基对结合小分子的贡献,试验结果如图4所示,Gly46、Leu63、Gln67、Tyr68、His73、Thr124、Gly125和Gln129对结合小分子的贡献较大,其中His73和Lys126残基可能作为亲核剂,为催化部位的活性位点,Gly46、Leu63、Gln67、Tyr68、Thr124、Gly125和Gln129可能与小分子结合识别有关。从表2我们也可以看出,His73为碱性氨基酸,带有正电荷,与小分子之前形成的静电相互作用和范德华作用力较强,结合能为-4.4088 k J/mol,Tyr68为疏水性氨基酸,极性溶剂自由能对静电作用影响较小,其对小分子的结合自由能为-4.6058 k J/mol,其他氨基酸残基对小分子的结合自由能贡献均低于-1 k J/mol。与上文对接试验结果较为一致。
| 图表编号 | XD00169560200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.01 |
| 作者 | 禹亚男、李婷 |
| 绘制单位 | 重庆医科大学附属第二医院医学重症监护科、重庆医科大学附属第二医院医学重症监护科 |
| 更多格式 | 高清、无水印(增值服务) |