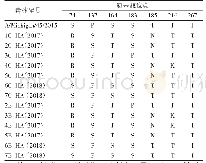
《表6 2014~2018年临沧市H3N2亚型流感病毒其它蛋白关键氨基酸突变位点以及PB1-F2蛋白长度分析》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《新一代全基因组测序揭示2014~2018年云南省临沧市H3N2亚型流感病毒的遗传突变机制》
注:氨基酸比对参照A/Texas/50/2012,“.”为氨基酸位点与A/Texas/50/2012对应位点相同。
流感病毒聚合酶是由3个蛋白(PA、PB1和PB2)所构成的异源三聚体。有报道称PA蛋白D216位于其第2个核定位信号区[23],与其进入细胞核的能力有关,A/Yunnan-Linxiang/11069/2014毒株PA蛋白发生了D216N变异(表6),这可能会影响病毒复制。还有14株毒株PA蛋白发生了Q256K变异,Q256是宿主适应性的特异位点[24]。有研究表明C端第668~692位氨基酸在调节PA生成聚合酶三聚体中与PB1之间的互作中起作用[25],本研究中部分毒株发生的V668I(9/29株)、V669I(17/29株)、N675K(11/29株)变异可能会影响这种相互作用,V668I突变还被研究证实与增强病毒温度适应性以及提高病毒复制能力和聚合酶活性有关[26]。A/Yunnan-Linxiang/11069/2014毒株PB1蛋白发生了T56M变异,而第56位氨基酸突变位于PB1与PA的结合区域,该突变可能会影响PB1与PA的结合。PB1-F2蛋白是由流感病毒PB1基因+1开放阅读框编码的多肽,是导致流感病毒致病性的重要蛋白之一。长度的多态性是影响其毒力作用的重要因素[27,28]。29株毒株共编码了3种长度不同的PB1-F2蛋白,其中2种全长蛋白均起始于第95位核苷酸,分别编码长度为90和87个氨基酸的蛋白。而截断的PB1-F2蛋白缺失N-端,编码长度为52个氨基酸的肽段,这与前人研究发现季节性H3N2亚型流感病毒产生的截断PB1-F2肽段长度通常为34aa不同[29]。而研究发现PB1-F2蛋白的N-端能增强病毒聚合酶活性以及PB1蛋白的表达水平[30],本研究中A/Yunnan-Linxiang/11069/2014毒株产生的缺失N-端型PB1-F2蛋白,可能会影响该病毒的复制。研究还发现PB2蛋白627K与增强病毒致病性以及宿主适应性有关[31],本研究所测毒株在此位点均未发生突变,这能有助于H3N2亚型流感病毒维持一定致病力。
| 图表编号 | XD00144513400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.01 |
| 作者 | 张汉菊、仇娜、周晓荣、赵晓南、徐闻、伏晓庆、张美玲 |
| 绘制单位 | 临沧市疾病预防控制中心、临沧市疾病预防控制中心、临沧市疾病预防控制中心、云南省疾病预防控制中心、云南省疾病预防控制中心、云南省疾病预防控制中心、云南省疾病预防控制中心 |
| 更多格式 | 高清、无水印(增值服务) |