《表1 HA上影响受体结合的氨基酸位点在各亚型流感病毒中的分布及作用》
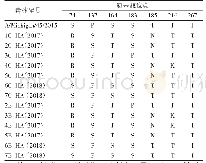
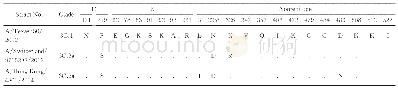
有些氨基酸替换在不同HA亚型流感病毒中起了相同或相似的作用(见表1)。其中最为显著的是HA基因上Q226L这一改变。研究表明,Q226L突变可以影响流感病毒H2、H3亚型人适应株的受体结合特异性:残基L226产生的疏水环境与亲水性糖苷氧的取向不相容,不利于结合α2,3-SA受体的疏水环境受体,但有利于匹配α2,6-SA受体的疏水性C6原子[30,31]。在H5亚型病毒中,残基L226营造的疏水性环境也更有利于HA与α2,6-SA受体的结合,甚至可以使病毒的受体结合特异性发生向α2,6-SA的转换[5,14]。同样地,Q226L替换可以增强H7亚型禽流感病毒与α2,6-SA受体的结合能力;促使H9病毒更偏好性结合α2,6-SA受体;还能够在极大地降低H10病毒与α2,3-SA受体结合的同时,略微增强病毒与α2,6-SA受体的亲和力[29,32~34]。此外,HA蛋白T160A或N158D突变导致的158N糖基化位点的缺失,也被证明可以通过增强与α2,6-SA受体的结合而影响H5、H9亚型流感病毒的受体结合特异性[5,29,35,36]。例如,在2.3.4分支H5N1病毒中,T160A突变不仅使病毒获得了结合α2,6-SA受体能力,而且可以在豚鼠之间进行接触传播;在2.3.4.4分支H5NX病毒(包括H5N2、H5N5、H5N6和H5N8亚型)中,T160A替换也是病毒同时具有α2,3-SA和α2,6-SA受体结合特性的关键分子基础[29,35,36]。当T160A&Q226L或T160A&G228S同时突变时,H5病毒的受体结合特性还会发生由α2,3-SA向α2,6-SA受体的转换[5]。还有研究指出,HA蛋白A138S、G186V的氨基酸替换均能使H5、H7亚型流感病毒与α2,6-SA受体的结合性增强,而且A138S在H1亚型流感病毒的宿主跳跃中也起到了重要作用[18,31~33]。另外,D190&D225可以促使H1病毒的HA蛋白优先结合α2,6-SA受体;但将此联合突变引入到H10病毒的HA时,却使病毒失去了对α2,3-SA和α2,6-SA受体的结合能力[34,37]。当然,有一些氨基酸替换仅发生于个别HA亚型中,未遍及所有亚型[27,29,30,34,37~40](见表1)。
| 图表编号 | XD0010902800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.11.10 |
| 作者 | 卜欣欣、顾敏、刘秀梵 |
| 绘制单位 | 扬州大学农业部畜禽传染病学重点开放实验室、江苏高校动物重要疫病与人兽共患病防控协同创新中心、扬州大学农业部畜禽传染病学重点开放实验室、江苏高校动物重要疫病与人兽共患病防控协同创新中心、扬州大学农业部畜禽传染病学重点开放实验室、江苏高校动物重要疫病与人兽共患病防控协同创新中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式