《表2 化合物3a~3t的合成》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《醋酸碘苯介导的α-重氮羰基化合物的去重氮双氧合反应》
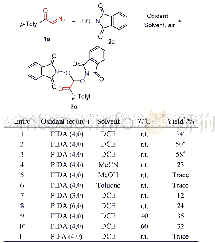
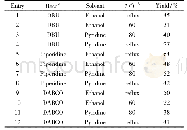
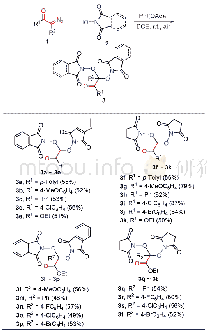
在最佳优化条件下,对该方法普适性进行了探索(表2).最初以N-羟基邻苯二甲酰亚胺(2a)为代表性底物考察了α-重氮羰基化合物上取代基R1与R2的适用范围.结果表明:R1为芳环及R2为H时,多种与苯环相连的取代基均能兼容此反应,如供电子基团的甲氧基(1b)和吸电子基团的氯(1d).从实验结果可以得出,芳基上基团的电子效应对产物收率影响不明显.此外,无取代基的苯基(1c)也能以中等收率得到目标产物3c.值得一提的是,重氮乙酸乙酯(1e)在此反应中被证实是一类良好的自由基受体,提供相应的目标产物3e,收率为51%.随后,用N-羟基丁二酰亚胺(2b)代替N-羟基邻苯二甲酰亚胺来评估反应的适用范围.固定R2为氢且调整α-重氮羰基化合物上的取代基R1为对甲苯基(1a)、对甲氧苯基(1b)、苯基(1c)、对氯苯基(1d)及对苯溴基(1f)时发现,上述取代基均可参与此反应,得到目标产物3f~3k,产率在50%~87%之间.其中α-重氮芳酮1a与重氮乙酸乙酯(1e)给出目标产物3f和3k的收率相对较低,其它官能团给出的收率较高,在79%~87%之间(3g~3j).为了继续拓展反应的适用范围,使用多种取代不同的α-芳基重氮酯1g~1k,如对甲氧苯基(1g)、苯基(1h)、对氟苯基(1i)、对氯苯基(1j)及对苯溴基(1k),分别与2a和2b进行反应.实验结果表明,上述底物1g~1k均能顺利参与此反应,得到一系列含有季碳中心的双氧合产物3l~3t,收率为46%~60%.收率低的原因可能是由于其空间位阻造成的.所合成的产物3的结构均经NMR谱和HRMS表征.此外,通过单晶X射线衍射进一步确定了化合物3a的结构(图1),英国剑桥晶体数据库(CCDC)号为1956604.
| 图表编号 | XD00141661000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.01 |
| 作者 | 李庆雪、李梦伟、时绍青、季晓霜、何春兰、姜波、郝文娟 |
| 绘制单位 | 江苏师范大学化学与材料科学学院、江苏师范大学化学与材料科学学院、江苏师范大学化学与材料科学学院、江苏师范大学化学与材料科学学院、江苏师范大学化学与材料科学学院、江苏师范大学化学与材料科学学院、江苏师范大学化学与材料科学学院 |
| 更多格式 | 高清、无水印(增值服务) |