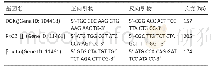
《表1 Real-time PCR所用的引物序列》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《5种核碱丙氨酸的合成及其抑制大鼠肝癌细胞RH35增殖的作用机制》
分别将5 ml BRL-3A细胞和RH35细胞接种至T25细胞培养瓶中,每瓶5×105个细胞/瓶,培养24h后更换含4 mmol/L的5种核碱丙氨酸完全培养基,对照组不含核碱丙氨酸。培养48 h后,0.25%胰蛋白酶消化收集细胞,按TRIzol(Invitrogen Corporation,Carlsbad,California,USA)说明书提取细胞总RNA,用紫外分光光度计测定260 nm和280nm的吸光度(absorbance,A),根据A260/280的比值测定RNA纯度。用变性琼脂糖凝胶电泳(70Ⅴ,20min)检测RNA的完整性。合格样品(28S/18S=2∶1)进行反转录。反转录时,按反转录试剂盒(Promega公司)说明书进行,模板为2μg总RNA。基因扩增按Reat-time PCR操作流程进行,即取1μl cDNA模板,加入1μl引物(表1),0.5μl dNTP,2.5μl PCR buffer,1μl SYBR Green,补dd H2O至总体积为20μl后,对待测基因CCNA2,PCNA,CASP3,CASP9,Bax和Bcl-2进行扩增,扩增条件:94℃2min,94℃30 s,56℃30 s,60℃30 s,共35个循环,实时采集每一反应管中荧光强度的变化,得到待测样品荧光信号到达设定阈值时所经历的循环数(cycle threshold,Ct),用2-△△Ct法对数据进行统计分析,计算出待测基因在5种不同核碱丙氨酸处理后的相对含量[15]。
| 图表编号 | XD00134275100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.04.06 |
| 作者 | 徐存拴、宋亚萍、许凯、杨晖、丁一、毕晶晶、赵茜怡、徐霆 |
| 绘制单位 | 河南师范大学生命科学学院河南省-科技部共建细胞分化调控国家重点实验室培育基地、河南师范大学生命科学学院河南省-科技部共建细胞分化调控国家重点实验室培育基地、河南师范大学生命科学学院河南省-科技部共建细胞分化调控国家重点实验室培育基地、河南师范大学生命科学学院河南省-科技部共建细胞分化调控国家重点实验室培育基地、河南师范大学生命科学学院河南省-科技部共建细胞分化调控国家重点实验室培育基地、河南师范大学化学化工学院、河南师范大学化学化工学院、河南师范大学化学化工学院 |
| 更多格式 | 高清、无水印(增值服务) |