《表3 检查计划举例:引入第三方认证机构参与医疗器械上市后监管的思考与实践》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《引入第三方认证机构参与医疗器械上市后监管的思考与实践》
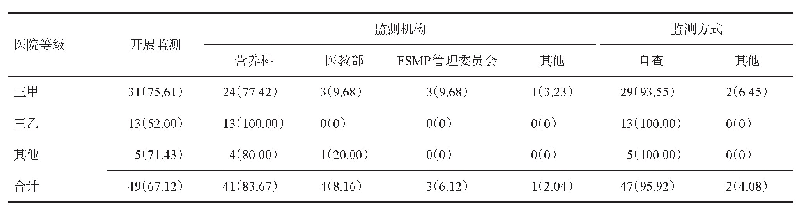
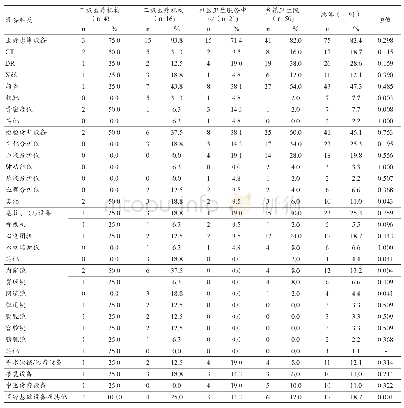
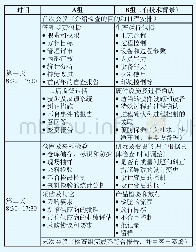
对检查启动及准备、检查实施过程、检查结果判定等内容进行了规定。现场检查可以以飞行检查的形式进行,第三方认证机构检查每家医疗器械生产企业时间为两天,参与检查人员不少于两人。现场检查由第三方认证机构的审核员进行,如现场发现有重大违法行为,可以转行政监管部门。现场检查可根据医疗器械生产企业已经上市的产品和上市后的监管情况抽样进行,重点关注人员管理、采购、硬件设施、生产运行、产品放行、上市后监测六个方面。表3中为供参考的检查计划示例,各机构可以依据自身情况来制定具体检查计划。
| 图表编号 | XD00129107400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.11.30 |
| 作者 | 林森勇、黎媛、穆玉彬 |
| 绘制单位 | 上海市药品监督管理局、上海市药品监督管理局、上海市药品监督管理局 |
| 更多格式 | 高清、无水印(增值服务) |