《表1 检查判定原则:引入第三方认证机构参与医疗器械上市后监管的思考与实践》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《引入第三方认证机构参与医疗器械上市后监管的思考与实践》
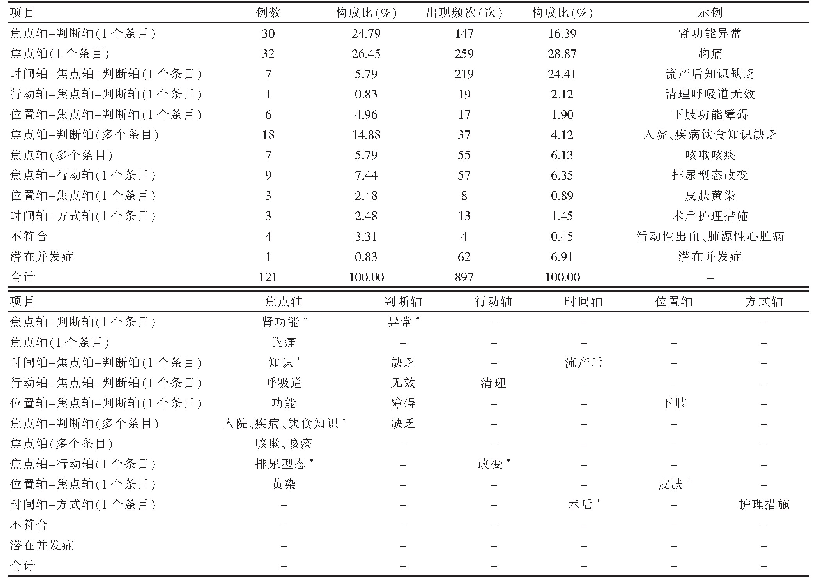
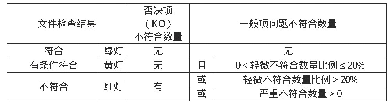
现场检查不符合项参照国际医疗器械监管者论坛(IMDRF和GHTF)的指南/准则分为5个等级:现场检查不符合项分为直接条款和间接条款的要求,间接条款是指对应的《医疗器械质量管理规范》条款要求不直接影响产品的质量和安全(类似于ISO13485 4.1-6.3条款),判为第1等级;直接条款要求是指和产品的质量和安全有直接影响的条款要求(类似ISO 13485 6.4-8.5条款),判为第3等级。直接条款和间接条款在现场检查表也有注明。检查判定原则见表1。
| 图表编号 | XD00129107300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.11.30 |
| 作者 | 林森勇、黎媛、穆玉彬 |
| 绘制单位 | 上海市药品监督管理局、上海市药品监督管理局、上海市药品监督管理局 |
| 更多格式 | 高清、无水印(增值服务) |