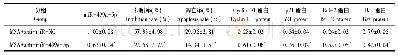
《表3 Swinholide A对不同细胞肌动蛋白聚合的抑制作用》
Swinholide A是从海绵Theonella sp.中分离出的具有大环内酯结构的二聚大环内酯化合物,具有细胞毒性[33]。Swinholide A能与G-肌动蛋白以摩尔比1∶2结合,并切断肌动蛋白丝[34]。KLENCHIN等[35]的研究清楚表明,Swinholide A与两分子G-肌动蛋白形成络合物,但是Swinholide A结合的2个G-肌动蛋白分子面对面,与肌动蛋白聚合中的头尾相接的二聚体不同。Swinholide A对细胞骨架和细胞形态的影响与拉春库林类似,但是与细胞松弛素不同[36]。LIM等[37]分别用DMSO和10μmol/L的Swinholide A在肌动蛋白聚合缓冲液中培养纯化的裂殖酵母球状肌动蛋白和人β-actin,荧光显微镜成像表明,当纯化的G-actin与DMSO、氯化镁和三磷酸腺苷混合时,F-actin很容易被观察到,而当G-actin与Swinholide A、氯化镁和三磷酸腺苷混合时,没有观察到F-actin;分别用DMSO或1μm Swinholide A处理预组装肌动蛋白丝时,全内反射荧光显微镜(TIRF)观察并测量肌动蛋白丝长度的结果表明,Swinholide A处理导致了肌动蛋白丝的断裂。该结果表明,Swinholide A既能抑制球状肌动蛋白的聚合,也能切断肌动蛋白微丝。使用Swinholide A对动物正常细胞和动物恶性细胞处理适当时间后,都可以观察到肌动蛋白微丝网络被破坏、单体肌动蛋白数量增加等现象,这些现象都表明肌动蛋白的聚合被抑制,见表3。
| 图表编号 | XD00115636000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.28 |
| 作者 | 刘琳、包广洁 |
| 绘制单位 | 西北民族大学口腔医学院、西北民族大学口腔医学国家民委重点实验室、西北民族大学口腔医学院、西北民族大学口腔医学国家民委重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式