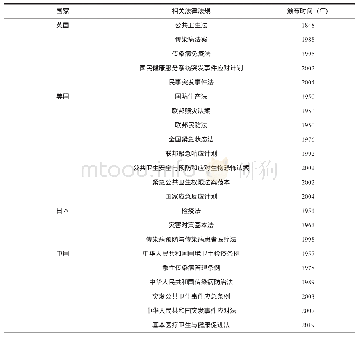
《表1 美国与基因治疗产品和临床试验相关的法律》
PHS:美国公共卫生署,CFR:美国联邦法规,FDA:美国食品和药物管理局
2.1法律 FDA根据风险高低,将基因和细胞治疗产品等生物制品分为“361”产品和“351”产品。“361”产品是指“操作极少、仅使用同源、未与其他物质相结合、没有系统效应(除特例外)”的生物制品。而不能符合所有上述特征的产品就是“351”产品。“351”产品一般是更复杂、更新颖的生物制品,应用风险较高,例如细胞体外扩增和基因修饰、激活等。其中,GT产品一般按照“351”产品来管理。美国法律对包括GT产品在内的各类生物制品的相关法律条款见表1。对于GT产品而言,法律中的规定比较概括,很少有实际操作层面的细节,但为法规和指南的制定提供了依据和指导。
| 图表编号 | XD00108286500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.25 |
| 作者 | 马兆君、李伟 |
| 绘制单位 | 中国药科大学国际医药商学院、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式