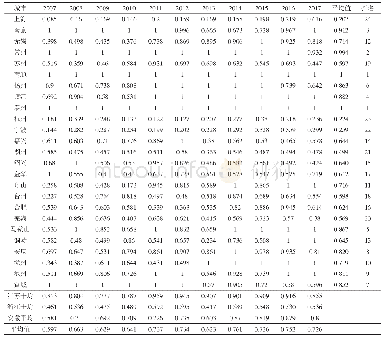
《表1 2007-2017财政年FDA发布的483》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《美国、欧盟、加拿大和中国发布的药品GMP合规检查信息简介及启示》
注:以上统计结果数并不代表2007-2017财政年发布的所有483记录,部分手写483未涵盖。
FDA cGMP 483现场观察报告(FORM FDA 483INSPECTIONAL OBSERVATIONS,以下简称483)是FDA检查官根据动态生产质量管理规范(current Good Manufacturing Practice,c GMP),对医药企业进行现场检查,将所发现的不符合c GMP之处,以表的形式列出总结清单[10-12]。除药品外,483还包括了食品、器械和兽药等领域。根据2007-2017财政年(2006年10月1日-2017年9月30日)统计数据来看[13],483记录共有54 878条,其中药品领域7353条,占比13.40%,见表1。同时,参照美国联邦法规21章(Code of Federal Regulations,21 CFR)第210、211部进行检查并发布的483(即c GMP 483)在药品领域483中所占比例高达90%以上,而21 CFR第211部正是FDA对药品生产的基本要求,是对药品生产企业进行检查的重要准则[11]。
| 图表编号 | XD0099168300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.20 |
| 作者 | 李年苏、谭顺洪 |
| 绘制单位 | 四川科伦药业股份有限公司、四川科伦药业股份有限公司 |
| 更多格式 | 高清、无水印(增值服务) |